
- •Практикум по курсу «Химия окружающей среды»
- •Глава 1. Некоторые вопросы пробоотбора и подготовки проб к анализу
- •§ 1. Отбор проб воды из различных источников.
- •§ 2. Разделение и концентрирование анализируемых компонент природных вод при подготовке проб к анализу.
- •§ 3. Консервирование и хранение проб воды.
- •Глава 2. Методики выполнения лабораторных работ работа 1. «Растворимость кислорода в природных водах».
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 2. «Стратификация и баланс содержания кислорода в поверхностных водах».
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 3. «Влияние кислорода на редокс-буферность и самоочищение природных вод от редокс-активных загрязнителей ».
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 4. «Водородный показатель рН, кислотность природных вод»
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 5. «Влияние карбонатов на кислотно-основные равновесия в природных водах»
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 6. «Определения класса природных вод по характеристикам минерального состава (минерализация, жесткость природных вод)»
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 7. «Определение содержания основных анионов в природных водах. Определение содержания сульфат-ионов различными методами. Определение содержания хлорид-ионов методм Мора».
- •Определение концентрации сульфат-аниона
- •Контрольные вопросы и задания для самостоятельной работы.
- •8. Для чего используется хромат калия в определении хлорид-ионов методом Мора? работа 8. «Определение содержания в воде различных форм азота».
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 9. «Качественное определение некоторых загрязнителей в природных и сточных водах»
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 10. «Определение искусственных загрязнителей в природных водах».
- •Контрольные вопросы и задания для самостоятельной работы.
- •«Определение органолептических показателей природных и сточных вод».
- •Хромово-кобальтовая шкала цветности
- •Задание 9. Определение содержания взвешенных частиц.
- •Работа 12. «Определение содержания железа в природных водах. Устойчивость соединений при различных значениях рН воды».
- •Контрольные вопросы и задания для самостоятельной работы.
- •Работа 13. Определение содержание особо токсичных элементов в природных и сточных водах.
- •Контрольные вопросы и задания для самостоятельной работы
- •Общие правила техники безопасности при работе в эколого-аналитической лаборатории.
- •Допустимые значения концентраций загрязняющих веществ в питьевой воде
- •Обобщенные показатели
- •Органолептические показатели
- •Показатели качества воды рыбохозяйственных водных объектов
- •Нормативы предельно допустимых концентраций химических и иных веществ в воде рыбохозяйственных водных объектов (выборочно)
Контрольные вопросы и задания для самостоятельной работы.
Какие вещества обусловливают естественную кислотность или щелочность природных вод? Что такое щелочность природных вод, основность природных вод?
В чем заключается сущность явления кислотно-основной буферности природных вод?
Какие процессы в природных водах протекают при контакте их с карбонатными породами? Как образуется карбонатная система пресных поверхностных вод?
В чем отличаются карбонатные системы атмосферных осадков и поверхностных вод? Могут ли эти системы иметь одинаковый состав?
Поясните сущность природных процессов, приводящих к подщелачиванию вод.В чем отличаются механизмы подщелачивания поверхностных и глубинных вод?
Поясните сущность природных процессов, приводящих к подкислению вод.
При каком значении водородного показателя жидкие осадки относят к кислотным?
Могут ли быть кислотными жидкие осадки, выпадающие из естественной незагрязненной атмосферы и почему? Какое значение водородного показателя для них характерно в этом случае?
По каким причинам естественные природные воды поверхностных водоемов могут иметь значение водородного показателя 8,4 – до 9?
По каким причинам естественные природные воды поверхностных водоемов могут иметь значение водородного показателя 5,6 – 5,7?
Работа 6. «Определения класса природных вод по характеристикам минерального состава (минерализация, жесткость природных вод)»
Цель работы: количественное определение в природных водах содержания кальция, магния, минеральных примесей, не разлагающихся при температурах 1050С. Определение класса поверхностных природных вод по характеристикам минерального состава – жесткости, минерализации.
Минерализация природных вод. Гидросфера Земли состоит из соленой воды (моря, океаны), пресной воды (реки, озера, водохранилища), твердой воды (снежный покров, ледники), а также пронизанной водой или парами воды литосферы и атмосферы. В состав вод гидросферы включаются также вода, входящая в состав живых организмов, т.е. воды биосферы.

Рис. 1. Виды вод гидросферы.
В
природе нет химически чистой воды. В
результат взаимодействия воды с
почвобразующими минералами и породами,
воздушной средой, а также протекания в
воде различных химических, физико-химических
и биологических процессов природная
вода представляет собой разбавленный
раствор. Наиболее распространенные
компоненты состава пресных вод –
неорганические соли (бикарбонаты,
хлориды и сульфаты кальция, магния,
калия и натрия). Главными природными
соединениями, определяющими естественный
минеральный состав континентальных
пресных вод, являются:
– галит,
![]() – гипс,
– кальцит,
– гипс,
– кальцит,
![]() – доломит. При
контакте природной воды с галитом в
раствор переходят катионы
натрия и анионы хлора. При
контакте с гипсом в природных водах
появляются катионы кальция и сульфат-ионы.
При
растворении карбоната
кальция и доломита, имеющих
широкое распространение в природе, в
воды поступают ионы кальция,
магния и гидрокарбоната. Катионы кальция
и магния являются преобладающими
катионами в составе пресных вод (таблица
1). В дождевой воде преобладающим
катионом является Na+,
а анионом –
– доломит. При
контакте природной воды с галитом в
раствор переходят катионы
натрия и анионы хлора. При
контакте с гипсом в природных водах
появляются катионы кальция и сульфат-ионы.
При
растворении карбоната
кальция и доломита, имеющих
широкое распространение в природе, в
воды поступают ионы кальция,
магния и гидрокарбоната. Катионы кальция
и магния являются преобладающими
катионами в составе пресных вод (таблица
1). В дождевой воде преобладающим
катионом является Na+,
а анионом –
![]() .
В небольших количествах в водах содержатся
некоторые растворимые в воде органические
вещества. Состав речной и дождевой воды
очень сильно зависит от территориальных
особенностей местности, наличия
источников антропогенного загрязнения
атмосферы.
.
В небольших количествах в водах содержатся
некоторые растворимые в воде органические
вещества. Состав речной и дождевой воды
очень сильно зависит от территориальных
особенностей местности, наличия
источников антропогенного загрязнения
атмосферы.
Таблица 1.
Содержание основных ионов в речной воде,
(средние значения, ммоль/л)
катионы |
анионы |
||||||||
|
|
|
|
другие |
|
|
|
|
другие |
0,23
|
0,14 |
0,33 |
0,03 |
менее 0,03 |
0,16 |
0,09 |
0,85 |
менее 0,09 |
менее 0,09 |
Количественным показателем содержания в воде растворенных веществ является ее общая минерализация. На практике общую минерализацию воды (в мг/л) определяют как массу сухого остатка, полученного в результате упаривания и высушивания при 1050С (до постоянной массы) профильтрованной пробы воды определенного объема. Такая методика определения минерализации не учитывает летучие органические соединения и по существу является методикой определения солесодержания в природной воде. Общая минерализация и сухой остаток отличаются на величину содержания летучих соединений (как, правило, не более 10%). Сухой остаток характеризует содержание растворимых минеральных, частично органических примесей, температура кипения которых заметно превышает 1050С, нелетучих с водяным паром и не разлагающихся при указанной температуре.
Природные воды отличаются по минерализации. Один из самых распространенных способов классификации вод основан на различиях в общем количестве растворенных неорганических (и частично органических) веществ, т.е. минерализации.
По величине минерализации природные воды делятся на 8 классов (таблица 2).
Таблица 2
Классификация природных вод по величине минерализации.
Минерализация, г/л |
Наименование вод (группа по минерализации) |
Менее 0,2 |
Ультрапресные |
0,2 – 0,5 |
пресные |
0,5 – 1,0 |
С относительно повышенной минерализацией |
1 – 3 |
Солоноватые |
3 – 10 |
Соленые |
10 – 35 |
C повышенной соленостью |
35 – 50 |
Переходные к рассолам |
50 – 400 |
рассолы |
Хорошая питьевая вода содержит не более 0,5 г/л солей. Но в некоторых районах для питья используют и воды, содержащие до 1–3 г/л растворенных солей. Соленые воды с общей минерализацией 3–10 г/л пригодны только для некоторых видов домашних животных. Ультрапресные воды обладают способностью выводить соединения кальция из организма человека, поэтому с осторожностью следует подходить к их использованию для питья. Могут сильно различаться по минерализации воды рек, озер и грунтовые воды.
Жесткость
природных
вод
это совокупность ее свойств,
обусловленных присутствием в ней
катионов кальция
![]() ,
магния
,
магния
![]() и отчасти железа
и отчасти железа
![]() ,
,
![]() ,
,![]() .
Принято жесткость воды
ассоциировать с катионами кальция и в
меньшей степени – магния. Железо,
марганец и стронций оказывают на
жесткость незначительное влияние по
сравнению с кальцием и магнием.
.
Принято жесткость воды
ассоциировать с катионами кальция и в
меньшей степени – магния. Железо,
марганец и стронций оказывают на
жесткость незначительное влияние по
сравнению с кальцием и магнием.
Карбонатная жесткость определяется присутствием в воде гидрокарбонатов и карбонатов (при рН>8.3) кальция и магния. Этот тип жесткости воды почти полностью устраняется при кипячении воды, потому получил название временной жесткости. При кипячении воды гидрокарбонаты превращаются в карбонаты, выпадает в осадок карбонат кальция и гидроксид магния:
+ 2
=
![]() +
+
,
+
+
,
+ 2
=
![]() + 2
+ 2
С ионами железа
реакция протекает сложнее из-за того,
что
в воде подвергается окислению кислородом
воздуха, а
![]() и
и
![]() –
гидролизу:
–
гидролизу:
![]()
![]()

4
+ 8
+ 2
+
= 8
+ 4![]() ↓
↓
Чем больше в воде железа, тем сильнее буро-желтая окраска у накипи, которая осаждается на стенках и дне сосуда. Некарбонатная (постоянная) жесткость определяется присутствием в воде сульфатов, хлоридов, нитратов кальция и магния: в воде наряду с катионами и имеются анионы , и др. При кипячении не устраняется. Общая жесткость представляет собой сумму карбонатной и некарбонатной жесткости.
Таблица 3
Классификация природных вод по общей жесткости
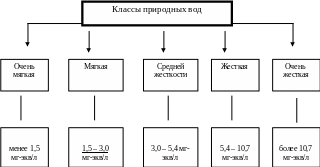
Катионы кальция и магния (в сумме) являются преобладающими катионами в составе пресных вод. Этот факт положен в основу классификации природных вод по жесткости (таблица 3). Жёсткость воды, как нормируемый показатель минерализации воды, выражается суммарным содержанием в ней ионов кальция и магния в мг-экв/л..
ЗАДАНИЕ 1. Определение общего содержания ионов кальция и магния (общей жесткости), класса воды по жесткости.
Метод измерения основан на титровании пробы воды раствором двунатриевой соли этилендиаминтетрауксусной кислоты (комплексон , ЭДТА, трилон Б, версен):

Рабочим раствором титранта в методе является раствор ЭДТА в концентрации 0,01–0,05 моль/л или 0,1 моль/л. Эта соль хорошо растворима в воде, растворы ее устойчивы при хранении. В обычных условиях препарат содержит около 0,3% влаги, поэтому раствор точной концентрации можно приготовить из навески с учетом 0,3% .
Стандартизация раствора титранта. Раствор точно известной концентрации называется стандартным раствором. Обычно раствор ЭДТА стандартизируют по раствору соли магния, полученному из фиксанала, или по раствору соли цинка, полученному растворением точной навески металлического цинка в соляной кислоте.
Т итриметрическая
реакция – реакция взаимодействия
комплексона с
ионами
с образованием хелатного соединения:
итриметрическая
реакция – реакция взаимодействия
комплексона с
ионами
с образованием хелатного соединения:

Точка эквивалентности (момент завершения реакции между титрантом и определяемым веществом).фиксируется при помощи металлоиндикаторов. Это сложные органические вещества, образующие с катионами металлов ярко окрашенные комплексные соединения.
При определении
общей жесткости воды, обусловленной
присутствием в воде катионов
и
,
используется индикатор эриохром черный
Т. Это вещество представляет собой
кислоту
![]() ,
при диссоциации которой в водном растворе
образуются ионы
,
при диссоциации которой в водном растворе
образуются ионы
![]() синего цвета. С ионами магния последние
образуют комплексное соединение красного
цвета.
синего цвета. С ионами магния последние
образуют комплексное соединение красного
цвета.
2 + (синий)
+
(синий)
![]()
![]() (красный)
+
(красный)
+
Когда в анализируемую
воду добавляют индикатор эриохром
черный Т, он образует комплексное
соединение красного цвета с ионами
магния – раствор окрашивается в
красный цвет. Затем красный раствор
титруют раствором ЭДТА. Вначале образуется
комплекс ЭДТА с ионами кальция (красная
окраска не исчезает), затем разрушается
комплекс магния с индикатором в результате
перехода магния в более прочный комплекс
с ЭДТА. Когда весь магний «уйдет» в
комплексное соединение с ЭДТА,
восстанавливается синяя (голубая)
окраска раствора, обусловленная
присутствием
![]() (индикатора эриохром черный Т). Схема
процессов:
(индикатора эриохром черный Т). Схема
процессов:
+ + эриохром черный Т комплекс (красный) +
( красный + )+ЭДТАкомплекс ЭДТА + красный +2
красный + ЭДТА + комплекс ЭДТА + (синий)
Изменение окраски в конце титрования с красной на голубую указывает на достижение точки эквивалентности. В ходе титриметрической реакции образуются ионы , потому полноту протекания реакции увеличивают, повышая раствора, что достигается введением в раствор щелочи или аммиачного буферного раствора. Титриметрическая реакция ЭДТА с катионом кальция возможна при 9–10. Вместо эриохрома черного Т может применяться индикатор мурексид.
Требования безопасности. При измерениях следует выполнять правила работы со стеклом, электронагревательными приборами, растворами кислот и оснований.
Подготовка к
выполнению измерений: воду профильтровать.
Интенсивно окрашенную воду пропустить
через колонку, наполненную активированным
углем БАУ со скоростью 2 мл/мин. Для
устранения мешающего влияния катионов
металлов (особенно ионов меди) в пробу
добавить 1 мл 2 %-ного раствора сульфида
натрия
![]() .
.
Выполнение измерений включает: приготовление индикатора, приготовление и стандартизацию рабочего раствора ЭДТА, приготовление аммиачного буферного раствора, титрование анализируемой пробы.
Приготовление рабочего раствора ЭДТА. Навеску 3,75 г ЭДТА растворяют в дважды дистиллированной воде, доводят объем раствора в мерной колбе до 1 л. Приблизительная концентрация раствора 0,02 н.
Приготовление индикатора. Навеску 0,5 г препарата эриохрома черного Т (хромогена черного) растирают в фарфоровой ступке с 50 г хлорида натрия – полученая смесь используется далее при стандартизации раствора ЭДТА (сухая смесь). Для приготовления раствора индикатора 0,5 г препарата хромогена-черного растворяют в 10 мл буферного раствора и доводят объем в мерной колбе до 100 мл этиловым спиртом.
Стандартизация рабочего раствора ЭДТА. Для определения точной концентрации раствора ЭДТА следует вначале приготовить два рабочих раствора: стандартный раствор хлорида цинка (раствор 1) и буферный раствор (раствор 2).
Раствор 1. Навеску металлического цинка х.ч. 0,3269 г, предварительно очищенного соляной кислотой, промытого дважды дистиллированной водой и высушенного при 100 0С для удаления влаги, помещают в мерную колбу на 1л, в которую затем наливают 10–15 мл дважды перегнанной дистиллированной воды и з мл концентрированной соляной кислоты. После полного растворения цинка (работать под тягой!) объем жидкости в колбе довести до метки дважды дистиллированной водой. Полученный раствор имеет концентрацию 0,01 н. по хлориду цинка. Если навеска цинка была не точно 0,3269 г, проводят пересчет нормальности полученного раствора по формуле (1):
![]() (1),
(1),
где N – нормальность полученного раствора хлорида цинка (первичный стандарт),
а – навеска цинка, реально взвешенная.
Раствор 2 (буферный). Навеску 20 г хлорида аммония, х.ч. растворяют в дистиллированной воде, добавляют 100 мл концентрированного раствора аммиака (работать под тягой!), доводят объем раствора в мерной колбе до 1 л.
Определение точной концентрации раствора ЭДТА. В коническую колбу для титрования наливают 10 мл стандартного раствора хлорида цинка, 5 мл буферного раствора, 10–15 мг сухой смеси (см. п.2), тщательно перемешивают. Полученный раствор титруют раствором ЭДТА до перехода окраски от красно-фиолетовой к голубой. Расчет нормальности раствора ЭДТА проводят по формуле (2):
![]() (2)
(2)
где
![]() – нормальность раствора ЭДТА,
– нормальность раствора ЭДТА,
![]() – нормальность стандартного раствора
хлорида цинка,
– нормальность стандартного раствора
хлорида цинка,
![]() – объем ЭДТА, затраченный на титрование,
– объем ЭДТА, затраченный на титрование,
![]() – объем стандартного раствора хлорида
цинка.
– объем стандартного раствора хлорида
цинка.
4. Титрование пробы воды. В коническую колбу емкостью 150–200 мл отмеривают пипеткой необходимый объем исследуемой пробы = 50 мл, добавляют 5 мл буферного раствора, 5–7 капель индикатора или 10–15 мг сухой смеси. Раствор перемешивают и титруют стандартизированным раствором ЭДТА до перехода красно-фиолетовой окраски в голубую.
Рассчитать общую
жесткость воды
![]() .
.
![]() ,
мг-экв/л
,
мг-экв/л
где – нормальность стандартизированного раствора ЭДТА;
– объем раствора ЭДТА, затраченного на титрование, мл;
– объем пробы воды, взятый для определения, мл.
Результаты определений:
Масса навески ЭДТА ______________
Масса навески цинка _______________
Нормальность раствора хлорида цинка ________________
Нормальность стандартизированного раствора ЭДТА _____________
Общая жесткость исследуемой воды _______________________
Класс воды по жесткости ________________________
ЗАДАНИЕ 2. Определение общей минерализации, класса воды по минерализации.
Метод измерения. Метод основан на измерении массы сухого остатка пробы воды после упаривания и высушивания остатка при температуре 1050С.
Требования безопасности. При измерениях следует выполнять правила работы с электронагревательными приборами. При обнаружении неисправности прибор немедленно выключить, поставить в известность штатный персонал лаборатории. Горячую чашку с остатком переносить специальными щипцами, ставить на асбестовую или керамическую подставку.
Подготовка к выполнению измерений. Изучить инструкцию по выполнению измерений на аналитических весах (инструкция к прибору). Профильтровать пробу воды из природного водоема.
Выполнение измерений. Прокалить, охладить и взвесить фарфоровую чашку. Поместить в чашку 100–200 мл исследуемой воды. Упарить воду досуха на водяной бане. Перенести чашку с остатком в сушильный шкаф и высушивать в нем 10–15 мин при температуре 1050С. Вынуть горячую (!) чашку из сушильного шкафа щипцами, поставить на асбестовую или керамическую подставку, охладить до комнатной температуры, взвесить. Повторить высушивание остатка в чашке при 1050С до постоянной массы.
Измерения повторить для всех проб, результаты внести в таблицу:
Проба воды |
Масса
пустой чашки,
|
Масса
чашки с остатком,
|
Масса сухого остатка,
( |
Объем пробы воды, , мл |
Минерализация
|
Класс воды по минерализации |
проба №1 |
|
|
|
|
|
|
проба №2 |
|
|
|
|
|
|
проба №3 |
|
|
|
|
|
|
