
Что такое СКВ
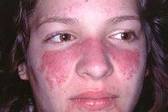
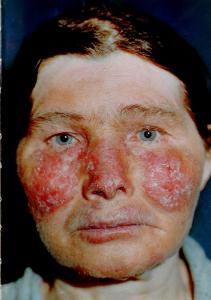
Схема патогенеза СКВ (моя – ИВ, а я – не эксперт в этой области), крупными блоками.
1. Усиление апоптоза и/или нарушение элиминации апоптотического материала макрофагами. Что он такое? – Это спрятанные глубоко в клетке, в клеточном ядре белки, связанные с ДНК, например, гистоны. В норме при разрушении ткани и при апоптозе образуется некоторое количество физиологических аутоантител. Это своеобразные АТ-«мусорщики»: опсонизируя апоптотический материал, они помогают макрофогам распознать его с помощью Fcгамма рецепторов.
2. У больных обнаруживают избыток ауто-АТ6 к ds-DNA (double-stranded DNA – двунитевая ДНК) и др. антигенам – см. статью.
Таким образом, есть:
1. Избыток аг (ds-DNA)
2. Избыток АТ
3. В этой ситуации механизмом повреждения обладают ауто-АТ (поэтому СКВ – аутоиммунное заболевание) и
комплексы АГ+АТ, если есть АГ>АТ. Такие комплексы мелкие, растворимые, склонны циркулировать в крови и рано или поздно фиксироваться на сосудистой стенке вызывая ее воспаление. И такое явление может наблюдаться во многих органах. А это уже называется иммунокомплексным поражением.
Отложение иммунных комплексов , антител и компонентов комплемента достаточно хорошо документируется и известно давно. Но это – вершина айсберга.
В иммунной системе больных СКВ обнаружены изменения:
1. дефекты фагоцитарного звена (см. схему в статье)
2. нарушения периферических механизмов толерантности (снижение количества клеток, уничтожающих аутореактивные В-лимфоциты, т.наз. the tingible body macrophages -TBM, специализированных макрофагов зародышевых центров л/узлов. Tingible – значит «окрашиваемых»). Т-лимфоциты переключают В-лц на продукцию высокоафинных АТ.
3. Нарушение продукции цитокинов (повышены уровни ИЛ-10, ИНФ-альфа)
Детали см. в двух приведенных статьях (англ.)
------------------------------------------------------------------------------------------------------------------------------------
Профессор д.м.н. Татьяна Магомедалиевна Решетняк
Институт ревматологии РАМН, Москва
Краткая история СКВ
Название красная волчанка, в латинском варианте как Lupus erythematosus, происходит от латинского слова «люпус», что в переводе на английский « wolf» означает волк и «эритематозус» - красная. Такое название было дано заболеванию из-за того, что кожные проявления были схожи с повреждениями при укусе голодным волком. Врачам этот недуг известен с 1828г, после описания французским дерматологом Biett кожных признаков. Спустя 45 лет после первого описания еще один врач дерматолог Kaposhi заметил, что некоторые больные с кожными признаками заболевания имеют еще и симптомы заболевания внутренних органов. И в 1890г. известный английский врач Osler обнаружил, что красная волчанка, называемая также системной, может протекать (хотя и редко) без кожных проявлений. В 1948г. был описан феномен LE-(ЛЕ)клеток, который характеризовался обнаружением в крови осколков клеток. Это открытие позволило врачам идентифицировать многих больных с СКВ. Только в 1954г. были выявлены в крови больных СКВ определенные белки (или антитела), которые действовали против собственных клеток. Обнаружение этих белков было использовано для разработки более чувствительных тестов для диагностики СКВ.
Что такое СКВ
Системная красная волчанка, также иногда называемая «волчанка» или коротко СКВ – тип нарушений иммунной системы, известный как аутоиммунное заболевание. При аутоиммунных заболеваниях организм, вырабатывая чужеродные белки к собственным клеткам и их компонентам, наносит ущерб своим здоровым клеткам и тканям. Аутоиммунное заболевание - это состояние, при котором иммунная система начинает воспринимать «свои» ткани как чужеродные и атакует их. Это ведет к воспалению и повреждению различных тканей организма. Волчанка – хроническое аутоиммунное заболевание, которое проявляется в нескольких формах и может вызывать воспаление суставов, мышц и различных других частей организма. Следуя из вышесказанного определения СКВ, понятно, что при этом заболевании поражаются различные органы организма, включая суставы, кожу, почки, сердце, легкие, кровеносные сосуды и мозг. Хотя у людей с этим заболеванием много различных симптомов, некоторые наиболее общие включают чрезмерную утомляемость, болезненные или опухшие суставы (артриты), необъяснимую лихорадку, кожные высыпания и проблемы с почками. СКВ относится к группе ревматических заболеваний. Ревматические заболевания включают те, сопровождающиеся воспалительным заболеванием соединительной ткани и характеризующиеся болями в суставах, мышцах, костях.
В настоящее время, СКВ относится к неизлечимым заболеваниям. Однако симптомы СКВ могут контролироваться соответствующим лечением, и большинство людей с этим заболеванием могут вести активную, здоровую жизнь. Почти у всех больных СКВ активность ее изменяется на протяжении заболевания, чередуясь моментами, называемыми вспышками – обострениями (в англоязычной литературе именуемые как пожар) и периодами хорошего самочувствия или ремиссии. Обострение заболевания характеризуется появлением или ухудшением воспаления различных органов. По принятой в России классификации активность заболевания делится на три стадии: I-я – минимальная, II-я – умеренная и III-я – выраженная. Кроме того, по началу возникновения признаков заболевания в нашей стране различают варианты течения СКВ– острое, подоострое и первично-хроническое. Такое разделение удобно при длительном наблюдении за больными. Ремиссия заболевания – состояние, при котором нет признаков или симптомов СКВ. Случаи полной или длительной ремиссии СКВ хотя и редки, но имеют место. Понимание как предотвратить обострение и как лечить их, когда они отмечаются, помогает больным с СКВ поддерживать свое здоровье. В нашей стране – в Институте ревматологии РАМН, так же как и в других мировых научных центрах, продолжаются интенсивные исследования по достижению огромных успехов в понимании болезни, которые могут привести к излечению.
Существуют два вопроса, изучаемые исследователями: кто заболевает СКВ и почему. Мы знаем, что женщины чаще, чем мужчины болеют СКВ и это соотношение по данным различных научных центров колеблется от 1:9 до 1:11. По данным американских исследователей СКВ в три раза чаще поражает чернокожих женщин по сравнению с белой расой, а также более распространена у женщин испанского, азиатского и коренного американского происхождения. К тому же, известны семейные случаи заболевания СКВ, но риск, что ребенок или брат или сестра пациента тоже заболеют СКВ до сих пор довольно низок. Нет в Росси статистических сведений о численности больных СКВ, так как симптомы заболевания варьируют в широких пределах от минимальных до тяжелых поражений жизненно-важных органов и начало их появления часто трудно указать точно.
На самом деле существует несколько видов СКВ:
системная красная волчанка, которая является формой заболевания, которую большинство людей имеют в виду, когда они говорят «волчанка» или в англоязычной литературе «люпус». Слово «системная» значит, что заболевание может поражать многие системы организма. Симптомы СКВ могут быть легкими или тяжелыми. Хотя СКВ в первую очередь поражает людей в возрасте от 15 до 45 лет, она может обнаружиться как в детстве, так и в пожилом возрасте. Эта брошюра акцентирует внимание на СКВ.
дискоидная красная волчанка преимущественно поражает кожу. Красная поднимающаяся сыпь может появиться на лице, коже черепа, или где-нибудь еще. Поднимающиеся области могут становиться толстыми и чешуйчатыми. Сыпь может продолжаться днями и годами или может рецидивировать (проходить и потом вновь появляться). Небольшой процент людей с дискоидной красной волчанкой позже развивают СКВ.
лекарственно индуцированная красная волчанка относится к форме волчанки, вызываемой лекарствами. Они вызывает некоторые симптомы похожие на подобные при СКВ (артрит, сыпь, лихорадка и боли в груди, но как правило не вовлекаются в процесс почки), которые исчезают при прекращении приема лекарств. Медикаменты, которые могут вызвать лекарственно индуцированную красную волчанку, включают: гидралазин (Аресолин), прокаинамид (Прокан, Пронестил), метилдопа (алдомет), гуинидин (Гуинаглют), изониазид и некоторые противосудорожные средства такие, как фенитоин (дилантин) или карбамазепин (Тегретол) и др..
неонатальная волчанка. Может поражать некоторых новорожденных, у женщин с СКВ или с определенными другими нарушениями иммунной системы. Дети с неонатальной волчанкой могут иметь тяжелые поражения сердца, которое является наиболее грозным симптомом. Некоторые новорожденныее могут иметь кожную сыпь, аномалии печени или цитопению (низкое количество клеток крови). В настоящее время врачи могут определять большинство больных с риском развития неонатальной СКВ, что позволяет быстро начинать лечение ребенка с рождения. Неонатальная волчанка встречается очень редко, и большинство детей, матери которых болеют СКВ, полностью здоровы. Следует отметить, что кожные высыпания при неонатальной волчанки обычно не требуют терапии и проходят самостоятельно.
Что вызывает системную красную волчанку?
Системная красная волчанка – сложное заболевание, причина которого не известна. Вероятно, что это не одна причина, а скорее комбинация нескольких факторов, среди которых генетические, факторы окружающей среды и, возможно, гормональные, сочетание которых может вызвать заболевание. Точная причина заболевания может отличаться у разных людей, провоцирующим фактором могут быть и стресс, и простудное заболевание, и гормональная перестройка организма, которая имеет место во время полового созревания, беременности, после аборта, во время менопаузы. Ученые достигли большого прогресса в понимании некоторых возникновения ряда симптомов СКВ, которые описаны в этой брошюре. Исследователи полагают, что генетика играет важную роль в развитии заболевания, однако, специфический «ген волчанки» до сих пор не определен. Вместо этого, появилось мнение, что несколько генов могут увеличить восприимчивость человека к этой болезни.
Факт, что волчанка может протекать в семьях, показывает, что развитие заболевания имеет генетическую основу. К тому же, изучение однояйцевых близнецов показало, что волчанка с большей вероятностью приведет к поражению обоих близнецов, у которых одинаковый набор генов, чем двоих разнояйцевых близнецов или других детей одних родителей. Так как риск заболеть для однояйцевых близнецов много меньше чем 100 процентов, поэтому ученые думают, что одни гены не могут объяснять факт возникновения волчанки. Другие факторы также должны играть роль. Среди них, которые интенсивно продолжают изучаться, включают солнечное излучение, стресс, определенные лекарства и инфекционные агенты, такие, как вирусы. В тоже время СКВ не является инфекционным или контагиознымзаболеванием, не относится к онкологическим заболеваниям и синдрому приобритенного иммунодефицита. Хотя вирус и может вызывать заболевание у восприимчивых к нему людей, человек не может «поймать» волчанку от какого-либо другого больного.
При СКВ иммунная система организма не работает так, как должна. Здоровая иммунная система продуцирует антитела, которые являются специфическими протеинами – белками, которые помогают бороться и разрушать вирусы, бактерии и другие чужеродные вещества, вторгающиеся в организм. При волчанке иммунная система продуцирует антитела (белки) против здоровых клеток и тканей собственного организма. Эти антитела, называемые аутоантителами («ауто» значит свои, собственные) способствуют воспалению различных частей организма, вызывая их опухание, покраснение, повышение температуры и боль. К тому же, некоторые аутоантитела соединяются с субстанциями из собственных клеток и тканей организма для формирования молекул, называемых иммунными комплексами. Образование этих иммунных комплексов в организме также способствует воспалению и повреждению тканей у больных волчанкой. Ученые еще не поняли все факторы, которые вызывают воспаление и повреждение тканей при волчанке и это является активной областью исследования.
Симптомы СКВ.
Несмотря на наличие определенных признаков заболевания, каждый случай больного СКВ различен. Клинические проявления СКВ могут колебаться от минимальных до тяжелых поражений жизненно-важных органов и могут периодически появляться и уходить. Общие симптомы волчанки приведены в таблице и включают повышенную утомляемость (синдром хронической усталости), болезненность и припухлость суставов, необъяснимую лихорадку и кожные высыпания. Характерная кожная сыпь может появиться на переносице и на щеках и из-за того, что по форме напоминает бабочку называется «бабочкой» или эритематозная (красная) сыпь на коже скуловой области. Высыпания красного цвета могут появиться на любой части кожи тела: на лице или ушах, на руках – плечах и кистях, на коже груди.
Общие симптомы СКВ
Болезненность и припухание суставов, мышечная боль
Необъяснимая лихорадка
Синдром хронической усталости
Высыпания на коже лица красного цвета или смена окраски кожиных покровов
Боли в грудной клетке при глубоком дыхании
Усиленное выпадение волос
Побеление или посинение кожи пальцев кистей или стоп на холоде или при стрессе (синдром Рейно)
Повышенная чувствительность к солнцу
Припухание (отеки) ног и/или вокруг глаз
Увеличение лемфатических узлов
Другие симптомы волчанки включают боль в груди, выпадение волос, чувствительность к солнцу, анемию (уменьшению красных клеток крови), и бледность или багровость кожи пальцев рук или ног от холода и стресса. Некоторые люди также испытывают головные боли, головокружение, депрессию или судороги. Новые симптомы могут продолжать появляться спустя годы после постановки диагноза, также как и различные признаки болезни могут проявиться в различное время.
У некоторых больных СКВ вовлекается только одна какая-либо система организма, например кожа или суставы, или органы кроветворения. У других больных проявления заболевания могут затрагивать многие органы и заболевание носит полиорганный характер. Тяжесть поражения систем организма различна у разных больных. Более часто поражаются суставы или мышцы, вызывая артриты или боль в мышцах - миалгии. Кожные высыпания довольно схожи у разных пациентов. При полиорганном проявлении СКВ следующие системы организма могут быть вовлечены в патологический процесс :
почки: воспаление в почках (волчаночный нефрит) может ухудшать их функциональную способность, которая сводится к эффективному выведению ненужных продуктов и токсинов из организма. Так как функциональная способность почек очень важна для общего здоровья, поражение их при волчанке, как правило, требует интенсивного медикаментозного лечения, чтобы предотвратить необратимые повреждения. Самому больному обычно трудно оценить степень поражения почек, так обычно воспаление почек при СКВ (волчаночном нефрите) не сопровождается болью, ассоциированной с вовлечением в процесс почек, хотя некоторые больные могут заметить, что их лодыжки опухли, появилась припухлость вокруг глаз. Часто показателем поражения почек при волчанке является ненормальный анализ мочи и уменьшение количества мочи.
центральная нервная система: у некоторых пациентов волчанка поражает мозг или центральную нервную систему. Это может вызывать головные боли, головокружение, нарушения памяти, проблемы со зрением, параличи или изменения в поведении (психозы), судороги. Некоторые из этих симптомов, однако, могут быть вызваны некоторыми лекарственными препаратами, в том числе и применяемыми для лечения СКВ или эмоциональным стрессом от знакомства с этим заболеванием.
кровеносные сосуды: кровеносные сосуды могут воспаляться (васкулиты), поражая путь, по которому кровь циркулирует в организме. Воспаление может быть слабым и не требовать лечения.
кровь: у больных волчанкой может развиться анемия или лейкопения (уменьшение числа белых и/или красных кровяных клеток). Волчанка также может вызвать тромбоцитопению - уменьшение числа тромбоцитов в крови, которое ведет к увеличению риска кровотечения. Некоторые пациенты с волчанкой имеют повышенный риск образования тромбов в кровеносных сосудах.
сердце: у некоторых людей с волчанкой воспаление может быть в артериях, которые приносят кровь к сердцу (коронарный васкулит), самом сердце (миокардит или эндокардит) или в серозной оболочке, которая окружает сердце (перикардит), вызывая боли в груди или другие симптомы.
легкие: некоторые больные СКВ развивают воспаление серозной оболочки легких (плеврит), вызывая боли в грудной клетке, одышку и кашель. Аутоиммунное воспаление легких называется пневмонитом. В воспалительный процесс могут вовлекаться другие серозные оболочки, покрывающие печень, селезенку, вызывая болезненность в соответствующем расположении данного органа.
Диагностика системной красной волчанки.
Диагностика волчанки может быть трудной. Это может занять месяцы или даже годы для врачей, чтобы собрать симптомы и точно диагностировать это сложное заболевание. Признаки, упоминаемые в этой части, больной может развивать в течение длительного периода болезни или за короткий промежуток времени. Диагностика СКВ строго индивидуальна и нельзя по наличию одного какого-либо симптома верифицировать это заболевание. Правильный диагноз волчанки требует знаний и осведомленности со стороны доктора и хорошая связь со стороны пациента. Рассказать доктору полную, точную медицинскую историю (например, какие проблемы со здоровьем у вас были и как долго, что провоцировало появление болезни) крайне необходимо для процесса диагностики. Эта информация, вместе с объективным обследованием и результатами лабораторных тестов, помогает врачу принимать во внимание другие заболевания, которые могут быть похожи на СКВ, или действительно подтвердить ее. Для постановки диагноза может потребоваться время, и болезнь может быть верифицирована не сразу, а только при появлении новых симптомов.
Нет одного теста, который может определить, болеет ли человек СКВ, но несколько лабораторных анализов могут помочь врачу поставить диагноз. Используют анализы, определяющие специфические аутоантитела часто присутствующие у больных волчанкой. Например, анализ на антинуклеарные антитела обычно проводится для выявления аутоантител, которые противодействуют компонентам ядра, или «командному центру» собственных клеток человека. Многие больные имеют положительный анализ на антинуклеарные антитела; однако, некоторые лекарства, инфекции и другие заболевания также могут вызвать положительный результат. Анализ на антинуклеарные антитела просто дает другой ключ для доктора делать заключение в постановке диагноза. Также есть анализы крови для индивидуальных типов аутоантител, которые более специфичны для людей с волчанкой, хотя не все люди с волчанкой имеют положительный для них результат. Эти антитела включают анти-ДНК, анти- Sm, RNP, Ro ( SSA), La ( SSB). Врач может использовать эти анализы, чтобы подтвердить диагноз волчанки.
Согласно диагностическим критериям Американской Коллегии Ревматологов, пересмотра 1982г., имеется 11 следующих признаков:
Одиннадцать диагностических признаков СКВ
высыпания красного цвета в скуловой области (в форме «бабочки», на коже груди в зоне «декольте», на тыле кистей)
дискоидная сыпь (чешуйчатые, дисковидной формы изъязвления чаще на коже лица, волосистой части головы или грудной клетке)
фоточувствительность (чувствительность к солнечным лучам за короткий промежуток времени (не более 30 минут)
язвы ртовой полости (боли в горле, на слистых ротовой полости или носа)
артриты (болезненность, припухание, скованность в суставах)
серозиты (воспаление серозной оболочки вокруг легких, сердца, брюшины, вызывая боль при перемене положения тела и часто сопровождающееся затруднением дыхания)_
вовлечение почек
проблемы, связанные с поражением центральной нервной системы (психозы и судороги, не связанные с приемом лекарств)
гематологические проблемы (уменьшение количества клеток крови)
иммунологические нарушения (которые увеличивают риск присоединения вторичных инфекций)
антиядерные антитела (аутоантитела которые действуют против ядер собственных клеток организма, когда эти части клеток ошибочно воспринимаются как чужеродные (антиген)
Диагностические правила для СКВ
Опрос о появлении признаков заболевания (анамнез заболевания), наличии родственников с любыми заболеваниями
Полный врачебный осмотр (от макушки до пяток)
Лабораторное обследование:
Общий клинический анализ крови с подсчетом всех клеток крови: лейкоцитов, эритроцитов, тромбоцитов
Общий анализ мочи
Биохимичекий анализ крови
Исследование общего комплемента и некоторых компонентов комплемента, которые часто выявляются в низком при высокой активности СКВ
Исследование антинуклеарных антител – позитивные титры у большинства больных, но позитивность может быть связана и с другими причинами
Исследование других аутоантител (антител к двуспиральной ДНК, к рибунуклеопротеиду (РНП), анти – Ro, анти- La) – один или более из этих тестов позитивны при СКВ
Исследование реакции Вассермана – исследование крови на сифилис, которое у части больных СКВ является ложнопозитивным, а не показателем болезни сифилисом
Биопсия кожи и/или почек
Лечение системной красной волчанки
Тактика лечения СКВ строго индивидуальна и может меняться со временем заболевания. Диагностика и лечение волчанки - часто объединенные усилия пациента и врачей, специалистов различных специальностей. Больной может обратиться к семейному доктору или терапевту, или может посетить ревматолога. Ревматолог – это доктор, который специализируется на артритах и других заболеваниях суставов, костей и мышц. Клинические иммунологи (врачи, специализирующиеся на нарушениях иммунной системы) могут также лечить пациентов с волчанкой. В процессе лечения часто помогают другие профессионалы: это могут быть медсестры, психологи, социальные работники и также врачи-специалисты такие как нефрологи (доктора, которые лечат заболевания почек), гематологи (специализируются на нарушениях крови), дерматологи (врачи, которые лечат заболевания кожи) и неврологи (доктора, специализирующиеся в нарушениях нервной системы).
Появляющиеся новые направления и эффективность лечения волчанки дают врачам больший выбор в подходе к лечению заболевания. Для пациента очень важно работать в тесном контакте с врачом и принимать активное участие в своем лечении. Диагностировав один раз волчанку, доктор планирует лечение, основываясь на пол, возраст пациента, состояние на момент осмотра, начало заболевания, клинические симптомы и условия жизни. Тактика лечения СКВ строго индивидуальна и может периодически меняться. Разработка плана лечения имеет несколько целей: предотвратить обострение, лечить его, когда оно имеет место, и свести к минимуму осложнения. Врач и пациент должны регулярно оценивать план лечения, чтобы убедиться, что он наиболее эффективен.
Несколько видов лекарственных препаратов используется для лечения СКВ. Доктор выбирает лечение, основываясь на симптомах и нуждах каждого пациента индивидуально. Для пациентов с болями и припуханием суставов, повышением их температуры применяют лекарства, которые уменьшают воспаление и относятся к нестероидным противовоспалительным препаратам (НПВП), они используются часто. НПВП могут использоваться одни или в комбинации с другими лекарствами, чтобы контролировать боль, припухание или повышение температуры. При покупке НПВП важно, чтобы это были указания врача, так как доза препарата для больных волчанкой может отличаться от дозы, рекомендованной на упаковке. Общие побочные эффекты НПВП, могут включать расстройства желудка, изжогу, понос и задержку жидкости в организме. Некоторые больные также отмечают развитие признаков поражения печени или почек во время приема НПВП, поэтому особенно важно для пациента оставаться в тесном контакте с врачом при лечении этими препаратами.
Основным препаратом для лечения СКВ являются препараты кортикостероидных гормонов, к которым относятся преднизолон (Делтазон), гидрокортизон, метилпреднизолон (Медрол) и дексаметазон (Декадрон, Гексадрол
SLE is incurable, but treatable.(не излечима, но лечится)
Pathophysiology
One manifestation of SLE is abnormalities in apoptosis, a type of programmed cell death in which aging or damaged cells are neatly disposed of as a part of normal growth or functioning.
In SLE, the body's immune system produces antibodies against itself, particularly against proteins in the cell nucleus. SLE is triggered by environmental factors that are unknown.
In order to preserve homeostasis, the immune system must balance between being sensitive enough to protect against infection, and becoming sensitized to attack the body's own proteins (autoimmunity). During an immune reaction to a foreign stimulus, such as bacteria, virus, or allergen, immune cells that would normally be deactivated due to their affinity for self tissues can be abnormally activated by signaling sequences of antigen-presenting cells. Thus triggers may include viruses, bacteria, allergens (both IgE and hypersensitivity), and can be aggravated by environmental stimulants such as ultraviolet light and certain drug reactions. These stimuli begin a reaction that leads to destruction of other cells in the body and exposure of their DNA, histones, and other proteins, particularly parts of the cell nucleus. The body's sensitized B-lymphocyte cells will now produce antibodies against these nuclear-related proteins. These antibodies clump into antibody-protein complexes which stick to surfaces and damage blood vessels in critical areas of the body, such as the glomeruli of the kidney; these antibody attacks are the cause of SLE. Researchers are now identifying the individual genes, the proteins they produce, and their role in the immune system. Each protein is a link on the autoimmune chain, and researchers are trying to find drugs to break each of those links.[2][39][40]
SLE is a chronic inflammatory disease believed to be a type III hypersensitivity response with potential type II involvement.[41] Reticulate and stellate acral pigmentation should be considered a possible manifestation of SLE and high titers of anticardiolipin antibodies, or a consequence of therapy.[42]
Abnormalities in cell death signalingApoptosis is increased in monocytes and keratinocytes
Expression of Fas by B cells and T cells is increased
There are correlations between the apoptotic rates of lymphocytes and disease activity.
Necrosis is increased in T lymphocytes.
Tingible body macrophages (TBMs) – large phagocytic cells in the germinal centers of secondary lymph nodes – express CD68 protein. These cells normally engulf B cells that have undergone apoptosis after somatic hypermutation. In some people with SLE, significantly fewer TBMs can be found, and these cells rarely contain material from apoptotic B cells. Also, uningested apoptotic nuclei can be found outside of TBMs. This material may present a threat to the tolerization of B cells and T cells. Dendritic cells in the germinal center may endocytose such antigenic material and present it to T cells, activating them. Also, apoptotic chromatin and nuclei may attach to the surfaces of follicular dendritic cells and make this material available for activating other B cells that may have randomly acquired self-specificity through somatic hypermutation.[43] Necrosis, a pro-inflammatory form of cell death, is increased in T lymphocytes, due to mitochondrial dysfunction, oxidative stress, and depletion of ATP.[44]
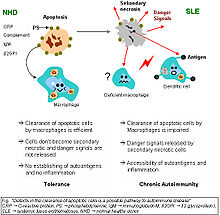
Clearance deficiency
![]()
Clearance deficiency
Impaired clearance of dying cells is a potential pathway for the development of this systemicautoimmune disease. This includes deficient phagocytic activity and scant serum components in addition to increased apoptosis.
Monocytes isolated from whole blood of SLE sufferers show reduced expression of CD44 surface molecules involved in the uptake of apoptotic cells. Most of the monocytes and tingible body macrophages (TBMs), which are found in the germinal centres of lymph nodes, even show a definitely different morphology; they are smaller or scarce and die earlier. Serum components like complement factors, CRP, and some glycoproteins are, furthermore, decisively important for an efficiently operating phagocytosis. With SLE, these components are often missing, diminished, or inefficient.
Recent research has found an association between certain lupus patients (especially those with lupus nephritis) and an impairment in degrading neutrophil extracellular traps (NETs). These were due to DNAse1 inhibiting factors, or NET protecting factors in patient serum, rather than abnormalities in the DNAse1 itself.[45] DNAse1 mutations in lupus have so far only been found in some Japanese cohorts.[46]
The clearance of early apoptotic cells is an important function in multicellular organisms. It leads to a progression of the apoptosis process and finally to secondary necrosis of the cells if this ability is disturbed. Necrotic cells release nuclear fragments as potentialautoantigens, as well as internal danger signals, inducing maturation of dendritic cells (DCs), since they have lost their membranes' integrity. Increased appearance of apoptotic cells also simulates inefficient clearance. That leads to maturation of DCs and also to the presentation of intracellular antigens of late apoptotic or secondary necrotic cells, via MHC molecules. Autoimmunity possibly results by the extended exposure to nuclear and intracellular autoantigens derived from late apoptotic and secondary necrotic cells. B and T cell tolerance for apoptotic cells is abrogated, and the lymphocytes get activated by these autoantigens; inflammation and the production of autoantibodies by plasma cells is initiated. A clearance deficiency in the skin for apoptotic cells has also been observed in people with cutaneous lupus erythematosus (CLE).[47]
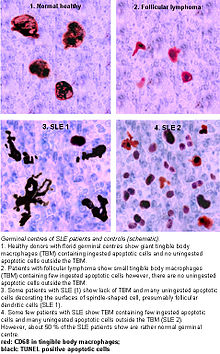
Germinal centres
Accumulation in germinal centers
In healthy conditions, apoptotic lymphocytes are removed in germinal centres (GC) by specialized phagocytes, the tingible body macrophages (TBM), which is why no free apoptotic and potential autoantigenic material can be seen. In some people with SLE,accumulation of apoptotic debris can be observed in GC because of an ineffective clearance of apoptotic cells. In close proximity to TBM, follicular dendritic cells (FDC) are localised in GC, which attach antigen material to their surface and, in contrast to bone marrow-derived DC, neither take it up nor present it via MHC molecules.
Autoreactive B cells can accidentally emerge during somatic hypermutation and migrate into the germinal center light zone. Autoreactive B cells, maturated coincidentally, normally do not receive survival signals by antigen planted on follicular dendritic cells, and perish by apoptosis. In the case of clearance deficiency, apoptotic nuclear debris accumulates in the light zone of GC and gets attached to FDC. This serves as a germinal centre survival signal for autoreactive B-cells. After migration into the mantle zone, autoreactive B cells require further survival signals from autoreactive helper T cells, which promote the maturation of autoantibody-producing plasma cells and B memory cells. In the presence of autoreactive T cells, a chronic autoimmune disease may be the consequence.
Anti-nRNP autoimmunity
Autoantibodies to nRNP A and nRNP C initially targeted restricted, proline-rich motifs. Antibody binding subsequently spread to other epitopes. The similarity and cross-reactivitybetween the initial targets of nRNP and Sm autoantibodies identifies a likely commonality in cause and a focal point for intermolecular epitope spreading.[48]
Others
Elevated expression of HMGB1 was found in the sera of patients and mice with systemic lupus erythematosus, high mobility group box 1 (HMGB1) is a nuclear protein participating in chromatin architecture and transcriptional regulation. Recently, there is increasing evidence HMGB1 contributes to the pathogenesis of chronic inflammatory and autoimmune diseases due to its proinflammatory and immunostimulatory properties.[49]
Diagnosis
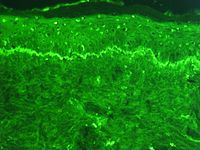
Microphotograph of a histological section of human skin prepared for direct immunofluorescence using an anti-IgG antibody. The skin is from a person with systemic lupus erythematosus and shows IgG deposits at two different places: The first is a bandlike deposit along the epidermalbasement membrane ("lupus band test" is positive); the second is within the nuclei of the epidermal cells (antinuclear antibodies are present).
Laboratory tests
Antinuclear antibody (ANA) testing and anti-extractable nuclear antigen (anti-ENA) form the mainstay of serologic testing for SLE. Several techniques are used to detect ANAs. Clinically the most widely used method is indirect immunofluorescence (IF). The pattern of fluorescence suggests the type of antibody present in the patient's serum. Direct immunofluorescence can detect deposits of immunoglobulins and complement proteins in the patient's skin. When skin not exposed to the sun is tested, a positive direct IF (the so-called Lupus band test) is an evidence of systemic lupus erythematosus.[50]
ANA screening yields positive results in many connective tissue disorders and other autoimmune diseases, and may occur in normal individuals. Subtypes of antinuclear antibodies include anti-Smith and anti-double stranded DNA (dsDNA) antibodies (which are linked to SLE) and anti-histone antibodies (which are linked to drug-induced lupus). Anti-dsDNA antibodies are highly specific for SLE; they are present in 70% of cases, whereas they appear in only 0.5% of people without SLE.[2] The anti-dsDNA antibody titers also tend to reflect disease activity, although not in all cases.[2] Other ANA that may occur in SLE sufferers are anti-U1 RNP (which also appears in systemic sclerosis), SS-A (or anti-Ro) and SS-B (or anti-La; both of which are more common in Sjögren's syndrome). SS-A and SS-B confer a specific risk for heart conduction block in neonatal lupus.[51]
Other tests routinely performed in suspected SLE are complement system levels (low levels suggest consumption by the immune system), electrolytes and renal function (disturbed if the kidney is involved), liver enzymes, and complete blood count.
The lupus erythematosus (LE) cell test was commonly used for diagnosis, but it is no longer used because the LE cells are only found in 50–75% of SLE cases, and they are also found in some people with rheumatoid arthritis, scleroderma, and drug sensitivities. Because of this, the LE cell test is now performed only rarely and is mostly of historical significance.[52]
Diagnostic criteria
Some physicians make a diagnosis on the basis of the American College of Rheumatology (ACR) classification criteria. The criteria, however, were established mainly for use in scientific research including use in randomized controlled trials which require higher confidence levels, so many people with SLE may not pass the full criteria.
Criteria
The American College of Rheumatology (ACR) established eleven criteria in 1982,[53] which were revised in 1997[54] as a classificatory instrument to operationalise the definition of SLE in clinical trials. They were not intended to be used to diagnose individuals and do not do well in that capacity. For the purpose of identifying patients for clinical studies, a person has SLE if any 4 out of 11 symptoms are present simultaneously or serially on two separate occasions. Useful mnemonic for remembering the diagnostic findings or symptoms of SLE is SOAP BRAIN MD (S=serositis, O=oral ulcers, A=arthritis, P=photosensitivity, pulmonary fibrosis, B=blood cells, R=renal, Raynauds, A=ANA, I=immunologic (anti-Sm, anti-dsDNA), N=neuropsych, M=malar rash, D=discoid rash), however, not in order of diagnostic importance.
Malar rash (rash on cheeks); sensitivity = 57%; specificity = 96%.[55]
Discoid rash (red, scaly patches on skin that cause scarring); sensitivity = 18%; specificity = 99%.[55]
Serositis: Pleurisy (inflammation of the membrane around the lungs) or pericarditis (inflammation of the membrane around the heart); sensitivity = 56%; specificity = 86% (pleural is more sensitive; cardiac is more specific).[55]
Oral ulcers (includes oral or nasopharyngeal ulcers); sensitivity = 27%; specificity = 96%.[55]
Arthritis: nonerosive arthritis of two or more peripheral joints, with tenderness, swelling, or effusion; sensitivity = 86%; specificity = 37%.[55]
Photosensitivity (exposure to ultraviolet light causes rash, or other symptoms of SLE flareups); sensitivity = 43%; specificity = 96%.[55]
Blood—hematologic disorder—hemolytic anemia (low red blood cell count) or leukopenia (white blood cell count<4000/µl),lymphopenia (<1500/µl) or thrombocytopenia (<100000/µl) in the absence of offending drug; sensitivity = 59%; specificity = 89%.[55] Hypocomplementemia is also seen, due to either consumption of C3[56] and C4 by immune complex-induced inflammation or to congenitally complement deficiency, which may predispose to SLE.
Renal disorder: More than 0.5 g per day protein in urine or cellular casts seen in urine under a microscope; sensitivity = 51%; specificity = 94%.[55]
Antinuclear antibody test positive; sensitivity = 99%; specificity = 49%.[55]
Immunologic disorder: Positive anti-Smith, anti-ds DNA, antiphospholipid antibody, and/or false positive serological test forsyphilis; sensitivity = 85%; specificity = 93%.[55] Presence of anti-ss DNA in 70% of cases (though also positive with rheumatic disease and healthy persons).[57]
Neurologic disorder: Seizures or psychosis; sensitivity = 20%; specificity = 98%.[55]
Other than the ACR criteria, people with lupus may also have:[58]
fever (over 100°F)
extreme fatigue
hair loss
fingers turning white and/or blue when cold (Raynaud's phenomenon)
Systemic Lupus Erythematosus
Anisur Rahman, Ph.D., and David A. Isenberg, M.D.
N Engl J Med 2008; 358:929-939February 28, 2008DOI: 10.1056/NEJMra071297
To the clinician, systemic lupus erythematosus is important because it is a potentially fatal disease that is easily confused with many other disorders. To the immunologist, lupus is intriguing because all the key components of the immune system are involved in the underlying mechanisms of the disease. This review describes these mechanisms and shows how knowledge of the pathogenesis of lupus facilitates its treatment.
The prevalence of lupus ranges from approximately 40 cases per 100,000 persons among Northern Europeans to more than 200 per 100,000 persons among blacks. 1 In the United States, the number of patients with lupus exceeds 250,000. The life expectancy of such patients has improved from an approximate 4-year survival rate of 50% in the 1950s2 to a 15-year survival rate of 80% today.3 Even so, a patient in whom lupus is diagnosed at 20 years of age still has a 1 in 6 chance of dying by 35 years of age, most often from lupus or infection. 4 Later, myocardial infarction and stroke become important causes of death.4 This bimodal pattern of mortality in lupus was recognized more than 30 years ago.5
The diverse presentations of lupus range from rash and arthritis through anemia and thrombocytopenia to serositis, nephritis, seizures, and psychosis. Lupus should be part of the differential diagnosis in virtually any patient presenting with one of these clinical problems, especially in female patients between 15 and 50 years of age.
Genetic and epidemiologic factors
Since 90% of patients with lupus are female, an important role for female hormones6 seems likely, but a protective role for male hormones or an effect of genes on the X chromosome is also possible. In a blinded, randomized, controlled trial, menopausal women with lupus who received hormone-replacement therapy containing conjugated estrogens and progesterone had a risk of a mild-to-moderate disease flare that was 1.34 times the risk among women who received placebo (P=0.01).7However, trials of hormonal treatments for lupus, such as dehydroepiandrosterone, have been disappointing.8 It is unclear how sex hormones could promote lupus.
Many drugs cause a variant of lupus called drug-induced lupus. The best known of these drugs are procainamide, hydralazine, and quinidine. Patients with drug-induced lupus usually present with skin and joint manifestations; renal and neurologic features are very rare.9 An antecedent viral-like illness may occur at the onset of lupus or immediately before a flare. Identifying a particular causative virus has proved challenging. Epstein–Barr virus (EBV) may be important, since a temporal association between the onset of lupus and the occurrence of EBV infection has been reported. A case–control study involving children and young adults showed that anti-EBV antibodies were present in 99% and EBV DNA was present in 100% of patients with lupus — much higher proportions than those in the control group.10 Ultraviolet radiation is the most obvious environmental factor linked to lupus. A photosensitive rash is a criterion of the American College of Rheumatology for the classification of the disease.11,12
The
concordance rate for lupus is 25% among monozygotic twins and
approximately 2% among dizygotic twins 13;
these rates indicate that a genetic contribution is important, but it
is not sufficient to cause the disease. Many genes that probably
contribute to lupus have been identified by means of whole-genome
scans from families in which multiple members have lupus.14,15 Eight
susceptibility loci that have been identified in these studies are
listed in Table
1TABLE
1
 Susceptibility
Loci with Confirmed Linkage to Systemic Lupus Erythematosus..
Susceptibility
Loci with Confirmed Linkage to Systemic Lupus Erythematosus..
Genes of the major histocompatibility complex (MHC), particularly HLA-A1, B8, and DR3, have been linked to lupus.16 The response of a T lymphocyte to an antigen is triggered when a receptor molecule on the surface of the T cell recognizes a complex formed by the antigen and an MHC peptide on the surface of an antigen-presenting cell. Different types of cells within the immune system, such as B cells, macrophages, and dendritic cells, can function as antigen-presenting cells. The MHC genotype determines which MHC molecules are available to the antigens that are present and thus how well the antigens can be recognized by T cells. For this reason, particular MHC genes are associated with a risk of an immune response to self-antigens and hence a risk of diseases such as lupus.
Null alleles that cause a deficiency of one of the early complement components — C1q, C2, or C4 — are a strong risk factor for lupus.17 Family studies have identified genes that are more likely to occur in patients with lupus than in their healthy relatives.14 Many of these genes encode components of the immune system. For example, a Scandinavian study identified strong linkage between lupus and single-nucleotide polymorphisms in two interferon-related genes (those encoding tyrosine kinase 2 and interferon regulatory factor 5).18
Wakeland and colleagues14 have identified genetic loci that promote lupus in mice.19 These loci, designated Sle 1, Sle 2, and Sle 3, contain genes that mediate the loss of immunologic tolerance to nuclear autoantigens, B-cell hyperactivity, and T-cell dysregulation, respectively.14 The Sle 1 cluster contains genes similar to those in regions 1q21–23 and 1q41 of human chromosome 1 that have been linked to lupus in humans.14
