
- •2. Как называют в зависимости от их функции электроды, входящие в состав гальванического элемента, используемого для потенциометрических измерений.
- •3. Какие индикаторные электроды используют в потенциометрическом анализе.
- •Вопрос 4.Какое уравнение описывает зависимость потенциала электрода от активностей потенциалопределяющих частиц?
- •Вопрос 5. Какой электрод сравнения чаще всего используется в настоящее время в потенциометрическом анализе?
- •7. Какие ионселективные электроды используют для анализа с/х продукции.
- •8. В каких координатах строят кривые потенциометрического титрования?
- •9. Как готовят стандартные растворы для построения градуировочного графика в методе ионометрии?
- •10. Какую роль играют алюмокалиевые квасцы при приготовлении стандартных и анализируемых растворов?
- •11. Какие сельскохозяйственные объекты можно анализировать с использованием метода потенциометрического анализа.
Вопрос 4.Какое уравнение описывает зависимость потенциала электрода от активностей потенциалопределяющих частиц?
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, истандартными электродными потенциалами окислительно-восстановительных пар.
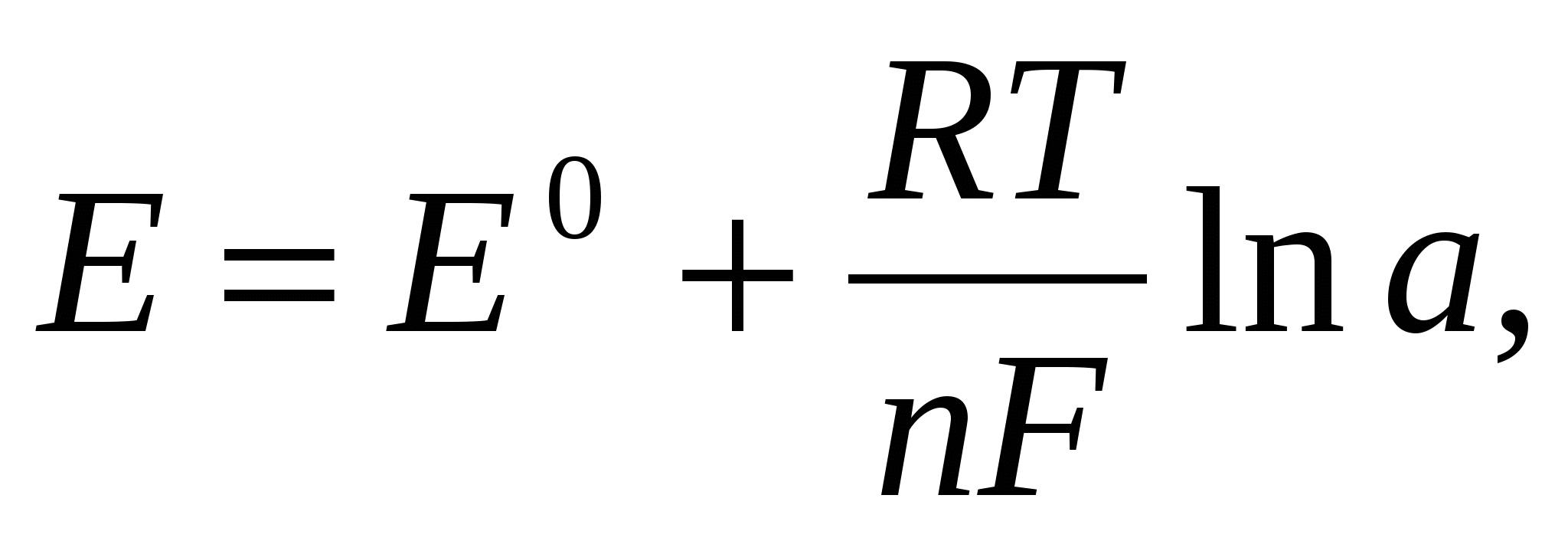
где
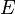 —
электродный
потенциал,
—
электродный
потенциал, 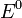 —
стандартный электродный потенциал,
измеряется в вольтах;
—
стандартный электродный потенциал,
измеряется в вольтах;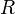 — универсальная
газовая постоянная, равная 8.31
Дж/(моль·K);
— универсальная
газовая постоянная, равная 8.31
Дж/(моль·K);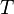 —
абсолютная
температура;
—
абсолютная
температура;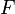 — постоянная
Фарадея, равная 96485,35 Кл·моль−1;
— постоянная
Фарадея, равная 96485,35 Кл·моль−1;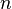 —
число моль электронов,
участвующих в процессе;
—
число моль электронов,
участвующих в процессе;a - активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Вопрос 5. Какой электрод сравнения чаще всего используется в настоящее время в потенциометрическом анализе?
Хлоридсере́бряный электро́д (ХСЭ) благодаря стабильности потенциала и простоте конструкции является одним из наиболее часто употребляемых в лабораторной практике электродов сравнения. Представляет собой серебряную пластинку или проволочку, покрытую слоем малорастворимой соли серебра(обычно - хлорида) и опущенной в насыщенный раствор хлорида калия. Схематически записывается как: Ag|AgCl|KCl|Cl−.
6. Какой индикаторный электрод используют для измерения рН и кислотно-основного титрования. В качестве индикаторного электрода при измерении активности водородных ионов (рН) в исследуемых растворах используют водородный электрод сравнения. Стандартный водородный электрод — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в водный раствор, содержащий ионы водорода. Потенциал пластины зависит от концентрации ионов Н+ в растворе. Электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции. В кислотно-основном титровании в качестве индикаторного обычно используют стеклянный электрод. Он включает в себя небольшой сосуд из стекла с помещенным в него стандартным раствором и токоотводом. Сосуд имеет горловину из изолирующего стекла, на конце которой напаян шарик из специального электродного стекла; обладающего заметной электропроводностью. Стекло проводит электричество благодаря тому что в нем могут мигрировать ионы щелочных металлов ( натрия или лития ), входящие в состав стекла при его синтезе. От других индикаторных рН - электродов стеклянный электрод отличается надежностью, высокой точностью измерений, устойчивостью к химическим воздействиям, в том числе со стороны сильных окислителей и восстановителей.
7. Какие ионселективные электроды используют для анализа с/х продукции.
Ионоселективным электродом называется индикаторный или измерительный электрод с относительно высокой специфичностью к отдельному иону или типу ионов. Ионоселективные электроды имеют следующие достоинства: они не оказывают воздействия на исследуемый раствор; портативны; пригодны как для прямых определений, так и в качестве индикаторов в титриметрии. [3] В зависимости от типа мембраны ионселективные электроды можно разделить на следующие группы: 1) твердые электроды - гомогенные, гетерогенные, на основе ионообменных смол, стекол, осадков, моно- и поликристаллов; 2) жидкостные электроды на основе жидких ионитов хелатов - нейтральные переносчики, биологически активных веществ; 3)азовые и энзимные электроды. Стеклянные электроды - наиболее распространенные электроды. С помощью данного вида электродов определяют рН растворов. Существуют стеклянные электроды, которые позволяют определить концентрацию ионов Na+, K+. Для защиты электрода от разрушения необходимо хранить его в воде, так как в воде происходит выщелачивание связанных ионными силами основных компонентов стекла и замена их ионами водорода. Сульфидсеребряные электроды - этот вид электродов является универсальным, с одной стороны Ag2S является основой одного из первых гомогенных кристаллических электродов с высокой избирательностью по отношению к ионам Ag+ и S2-, с другой стороны - Ag2S оказался превосходной инертной матрицей для кристаллических галогенидов серебра и многих сульфидов двузарядных металлов. Ферментные электроды позволяют определить концентрацию не только субстратов, но и в-в, являющихся ингибиторами или активаторами каталитич. р-ций. И. э. находят применение в хим. анализе для изучения комплексообразования, ассоциации ионов и др.
