
- •2. Как называют в зависимости от их функции электроды, входящие в состав гальванического элемента, используемого для потенциометрических измерений.
- •3. Какие индикаторные электроды используют в потенциометрическом анализе.
- •Вопрос 4.Какое уравнение описывает зависимость потенциала электрода от активностей потенциалопределяющих частиц?
- •Вопрос 5. Какой электрод сравнения чаще всего используется в настоящее время в потенциометрическом анализе?
- •7. Какие ионселективные электроды используют для анализа с/х продукции.
- •8. В каких координатах строят кривые потенциометрического титрования?
- •9. Как готовят стандартные растворы для построения градуировочного графика в методе ионометрии?
- •10. Какую роль играют алюмокалиевые квасцы при приготовлении стандартных и анализируемых растворов?
- •11. Какие сельскохозяйственные объекты можно анализировать с использованием метода потенциометрического анализа.
Вопрос №27
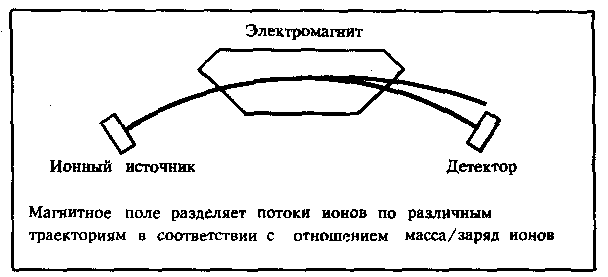
Современные масс-спектрометры состоят из нескольких устройств:
источника ионов — преобразует составляющие неорганического или органического вещества — нейтральные молекулы и атомы — в заряженные частицы — ионы,
микробиологического анализатора — разделяет заряженные ионы по времени пролета в масс-спектрометре определенного расстояния,
детектора — фиксирует сигнал ионов.
Вопрос №1
Прямая потенциометрия
Метод прямой потенциометрии основан на определении концентрации иона непосредственно по измеренной ЭДС электрохимической цепи, содержащей соответствующий ионоселективный электрод.
Расчет может быть выполнен по уравнению Нернста, известны все параметры, входящие в это уравнение. Однако величины fан и Едиф заранее неизвестны, поэтому используют приемы, позволяющие обойти эти трудности (метод градуировочного графика и метод добавок).
Для этого заранее строят градуировочный график в координатах ЭДС - lgСан с использованием стандартных растворов анализируемого иона, имеющих одинаковую ионную силу paствора.
В этом случае fан и Едиф остаются постоянными и график становится линейным. Затем по той же ионной силе измеряют ЭДС цепи с анализируемым раствором и по графику определяют концентрацию раствора.
Метод добавок. Это группа методов, основанная на введении в анализируемый раствор добавки раствора анализируемого иона с известной концентрацией. Добавка может быть одноразовой - метод единичной добавки; двухразовой - метод двойной добавки; многоразовой - метод многократных добавок.
Метод нашел применение в различных областях химии, в биохимии, медицине и фармации. Этот метод рекомендуется для фармацевтического анализа Европейской фармакопеей и Государственной фармакопеей Украины.
2. Как называют в зависимости от их функции электроды, входящие в состав гальванического элемента, используемого для потенциометрических измерений.
По назначению электроды делятся на электроды сравнения и индикаторные.
Электроды сравнения. При измерении ЭДС обратимых гальванических элементов необходим полуэлемент, потенциал которого был бы неизвестен, постоянен и не зависел бы от состава полученного раствора. Электрод удовлетворяющий этим требованиям, называют электродом сравнения.
В качестве электрода (полуэлемента) сравнения могут служить такие электроды, на поверхности которых при соприкосновении с подходящим раствором возникают лишь обратимые электрохимические реакции. Благодаря этому приобретаемые ими с большой скоростью потенциалы устойчивы. При прохождении небольших токов в замкнутой цепи потенциалы таких полуэлементов практически остаются постоянными, поэтому их причисляют к неполяризуемым электродам.
Наиболее часто применяемым на практике электродом сравнения является насыщенный каломельный электрод (Нас. КЭ), состоящий из металлической ртути, твердых фаз Hg2Cl2 и KCl и насыщенного этими соединениями раствора.
В качестве других электродов сравнения применяются каломельные электроды с 0,1 и 1 н. растворами хлорида калия (0,1 НКЭ, НКЭ соответственно), меркуриодидный (МИЭ), хлорсеребряный, меркурсульфатный и другие полуэлементы, состав и E равн которых можно найти в химических справочниках. С таким же успехом можно использовать стеклянный и хингидронный электроды.
Большинство электродов сравнения относится к электродам второго рода.
Индикаторные электроды. Электрод, потенциал которого зависит от концентрации определяемого иона в растворе, называется индикаторным (измерительным).
Одним из основных требований к индикаторным электродам, кроме определенной зависимости от активности (концентрации), является воспроизводимость и быстрота отклика потенциала при изменении активности иона. Известны два основных вида индикаторных электродов – металлические и мембранные.
Металлические индикаторные электроды можно изготавливать из различных металлов, способных давать обратимые полуреакции, например, из серебра, меди, ртути, свинца, кадмия. Потенциалы этих металлов воспроизводимо и предсказуемо отражают активность их ионов в растворе. Металлические электроды служат не только для определения собственных ионов; косвенно они чувствительны к анионам, образующим малорастворимые осадки с этими ионами. В этом случае необходимо только насытить изучаемый раствор малорастворимой солью. Например, серебряный электрод, чувствительный к ионам серебра, будет правильно отражать и концентрацию хлорид ионов в растворе, насыщенном хлоридом серебра. И, если по отношению к ионам Ag+ он будет электродом первого рода, то при определении Сl- - электродом второго рода, поскольку он измеряет концентрацию ионов, не участвующих непосредственно в процессе переноса электронов, то есть в электродной реакции. В отличие от рассмотренных электродов, потенциал которых определяется процессами переноса электронов между ионами в растворе и металлом (то есть электрохимической реакцией), в мембранных ионоселективных электродах возникновение потенциала связано с процессом обмена ионов между мембраной и раствором. Процесс переноса через мембрану состоит из двух фаз: проникновение иона в мембрану и перемещение иона внутри мембраны. При этом на поверхности возникает потенциал, который начинает препятствовать дальнейшему перемещению ионов и, в конечном счете, устанавливается динамическое равновесие, при котором устанавливается потенциал, подчиняющийся уравнению Нернста. Мембранный электрод – это устройство цилиндрической трубчатой формы, в котором ионоселективная мембрана разделяет внутренний и внешний (анализируемый) растворы и одновременно служит средством электролитического контакта между ними. Во внутренний раствор постоянного состава, содержащий ионы, к которым селективна мембрана, опущен токоотводящий электрод, обеспечивающий контакт мембранного электрода с измерительным прибором. Причем для токоотводящего электрода (обычно это платиновая или серебряная проволока) созданы условия постоянства его потенциала.
Существующие ионоселективные электроды можно разделить на электроды с твердой мембраной, жидкой мембраной и стеклянные электроды.
