
- •Определение размеров частиц в дисперсной системе методом непрерывного взвешивания.
- •«Седиментационный анализ методом непрерывного взвешивания осадка»
- •Седиментационная кривая .
- •Нахождение предела седиментационной кривой.
- •Интегральная кривая распределения .
- •Дифференциальная кривая распределения . Наиболее вероятный размер частиц 2 мкм .
- •Изучение зависимости поверхностного натяжения и адсорбции от концентрации раствора пав методом Ребиндера (максимального давления пузырька).
- •Образец оформления протокола по лабораторной работе:
- •Наибольшего давления пузырьков” Выполнил студент … группы … курса …………..Факультета
- •Исходные данные исследуемой жидкости :
- •Результаты измерений поверхностного натяжения и расчеты величин г и Сср/г :
- •Зависимость сср / г от с .
- •3. Изучение адсорбции органической кислоты на твердом адсорбенте.
- •Лабораторная работа №3
- •Органических кислот на твёрдых адсорбентах”.
- •Образец оформления протокола по лабораторной работе №3.
- •Изотерма адсорбции
- •Нахождение констант в уравнении Фрейндлиха.
- •4. Очистка коллоидного раствора от электролита методом электродиализа.
- •Лабораторная работа №5. Исследование зон коагуляции с помощью фотоэлектроколориметра .
- •6. Исследование процесса набухания твёрдых полимеров .
- •Образец оформления протокола по работе:
Интегральная кривая распределения .
Таблица 3 (VI.3).
R |
Q |
ΔQ |
ΔQ/Δr |
2 |
16 |
16 |
8 |
4 |
31 |
15 |
7.5 |
6 |
44 |
13 |
6.5 |
8 |
54 |
10 |
5 |
10 |
63 |
9 |
4.5 |
15 |
79 |
16 |
3.4 |
20 |
91 |
12 |
2.4 |
25 |
97 |
6 |
1.2 |
30 |
99 |
2 |
0.4 |
35 |
100 |
1 |
0.2 |
39 |
100 |
0 |
0 |
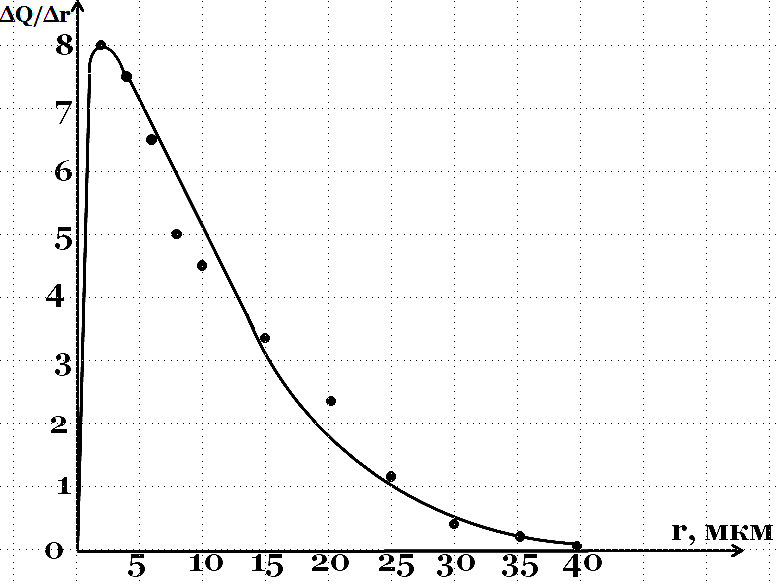
Дифференциальная кривая распределения . Наиболее вероятный размер частиц 2 мкм .
Изучение зависимости поверхностного натяжения и адсорбции от концентрации раствора пав методом Ребиндера (максимального давления пузырька).
В этом методе происходит выдувание пузырька воздуха из капилляра в смачивающую его жидкость, при этом давление, необходимое для отрыва пузырьков от кончика капилляра, прямо пропорционально поверхностному натяжению жидкости, удерживающему пузырек. По мере выдувания пузырька это давление возрастает , достигая своего максимального значения ΔPm в тот момент, когда пузырек примет форму полусферы, т.е.когда радиус его кривизны R станет равным радиусу капилляра r. Это максимальное давление внутри пузырька ΔPm прямо пропорционально поверхностному натяжению жидкости , и в этом случае применима формула Лапласа в виде :
( VII.38 ) ΔPm = 2 σ / r .
(Строго говоря, в этой формуле должен присутствовать добавочный член, учитывающий гидростатическое давление столба жидкости, находящегося над пузырьком : h*ρ*g , где h – глубина погружения капилляра в жидкость. Именно для того, чтобы избавиться от него, при практических измерениях стараются сделать так, чтобы кончик капилляра не погружался в жидкость, а только касался её поверхности, тогда можно считать,
что h = 0 ).
Давление
внутри пузырька ΔPm
обычно
измеряют по разности уровней жидкости
в водяном манометре, соединенном с
капилляром. Эта разность
 складывается
из суммы подъема и опускания уровня
воды в разных коленах манометра от
равновесного состояния, причем Δhm
= ΔPm
/(ρ*g)
, а формула
(VII.38)
может быть
теперь записана , как :
σ = ( Δhm*ρ*g
)*r/2
. Чтобы
избежать трудностей, связанных с
экспериментальным определением радиуса
капилляра r
, мы можем
принять часть последней формулы за
константу капилляра, обозначив её, как
Kк
= ( ρ*g*r)/2.
складывается
из суммы подъема и опускания уровня
воды в разных коленах манометра от
равновесного состояния, причем Δhm
= ΔPm
/(ρ*g)
, а формула
(VII.38)
может быть
теперь записана , как :
σ = ( Δhm*ρ*g
)*r/2
. Чтобы
избежать трудностей, связанных с
экспериментальным определением радиуса
капилляра r
, мы можем
принять часть последней формулы за
константу капилляра, обозначив её, как
Kк
= ( ρ*g*r)/2.
Для определения этой константы производят измерения Δh0m для стандартной жидкости с точно известной величиной поверхностного натяжения σ0 при данной температуре, после чего вычисляют константу капилляра по формуле :
(VII.41)

В качестве стандартной жидкости обычно используют дистиллированную воду, для которой величина σ0 при 200 С равна 72,75 мН/м . Определив константу капилляра Кк , проводят серию измерений растворов с неизвестными значениями поверхностного натяжения и вычисляют их по формуле :
(VII.41a)

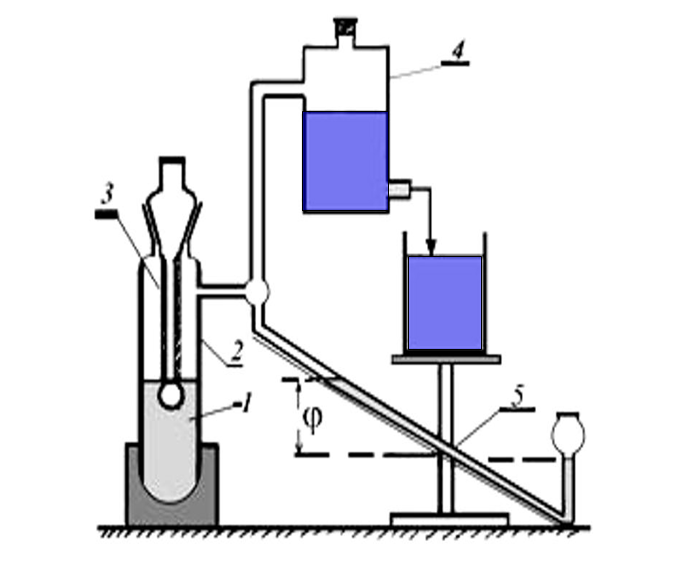
Для выполнения этой работы в лаборатории удобно пользоваться специальным
прибором, разработанным академиком П.А.Ребиндером ( рис. VII.22 ).
Исследуемую жидкость (1) наливают в термостатированный сосудик (2) с боковым отростком, в который опускают капилляр (3). Боковой отросток соединен с устройством для создания разрежения в сосудике
[аспиратором (4) – герметичным стеклянным цилиндром, разрежение воздуха в котором создается за счет вытекающей из него воды ], при этом происходит просасывание воздуха через кончик капилляра в жидкость с образованием пузырьков .
С системой соединен водяной манометр(5), позволяющий определять величины давления в пузырьке по разности уровней воды в обоих коленах манометра (ΔhX =h1+h2) .
Перед началом работы тщательно промывают хромовой смесью, обычной водой, а затем дистиллированной водой измерительный капилляр, сосудик и все рабочие колбы. После этого наливают в сосудик 5 –10 мл дистиллированной воды, погружают туда капилляр так, чтобы он только касался поверхности жидкости, но не был погружен в нее. Сосуд помещают в термостат и соединяют с аспиратором, внимательно следя за тем, чтобы уровень воды в аспираторе находился между двумя метками, а в соединительных трубках не было даже капель воды. Скорость вытекания воды из аспиратора регулируют таким образом, чтобы число воздушных пузырьков, проходящих через капилляр, составляло 5 – 8 в минуту. Отсчет показаний манометра производят с помощью увеличительного стекла, фиксируя величину h01 и h02 для каждого колена отдельно, и используя в дальнейшем их сумму Δh0m = h01+h02. Затем вычисляют константу капилляра Кк по формуле (VII.41), причем проделывают эти измерения не менее пяти раз. Результаты расчетов константы Кк проверяют у преподавателя. После этого приступают к приготовлению исследуемых растворов, которые готовят из исходного раствора ПАВ, полученного у преподавателя, последовательным разведением каждого предыдущего раствора дистиллированной водой в два раза .
В результате получается серия из шести растворов (исходная задача и пять разбавлений) с концентрациями (с0 ; с0/2 ; с0/4;……… с0/32 ). Дальнейшие измерения проводят таким же образом, как и при вычислении константы капилляра, начиная с самого разбавленного раствора и переходя от меньшей концентрации к большей. Рассчитанные по формуле (VII.41) значения σх проверяют у преподавателя по мере нахождения каждого . Закончив измерения серии растворов, получают у лаборанта данные об исследуемом ПАВ (исходная концентрация, молекулярная масса, плотность), после чего строят график зависимости σ от с и заносят данные измерений в протокол работы аналогично приведенному ниже примеру :
