
- •Глава 1. Определение, эпидемиология и социально-экономическая значимость хронической обструктивной болезни легких
- •Глава 2. Факторы риска
- •Глава 3. Патогенез, патоморфология и патофизиология
- •Бронхиальная астма хобл
- •В оспаление Поражение мелких бронхов Деструкция паренхимы
- •Ограничение скорости выходящего воздушного потока
- •Глава 4. Клиническая диагностика
- •Глава 5. Лечение
- •5.1. Введение
- •5.2. Уменьшение воздействия факторов риска
- •5.3. Лечение хронической обструкивной болезни
- •5.4. Диагностика и лечение обострений
- •I. Патогенез симптомов
- •II. Синдромы
- •Синдром эмфиземы легких (гипервоздушности легочной ткани).
- •Синдром поражения бронхов.
- •Синдром хронической дыхательной недостаточности.
- •Синдром легочной гипертензии.
- •Синдром поражения миокарда (гипертрофия и дилатация правого желудочка и правого предсердия).
- •Синдром хронической правожелудочковой недостаточности.
- •III. Диагноз
- •IV. Оценка результатов дополнительного обследования.
- •V. Лечение
- •Список использованной литературы
- •Список рекомендуемой литературы основная литература
- •Дополнительная литература
В оспаление Поражение мелких бронхов Деструкция паренхимы
(обструктивный бронхиолит)
Воспаление бронхов Потеря альвеолярных связей
Ремоделирование бронхов Уменьшение эластической тяги
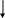
Ограничение скорости выходящего воздушного потока
Схема 2. Механизмы, лежащие в основе ограничения скорости
воздушного потока при ХОБЛ
Необратимый компонент объясняется, в первую очередь, ремоделированием мелких дыхательных путей – фиброзом и сужением бронхов, что вызывает необратимую обструкцию и последующее повышение сопротивления дыхательных путей. Местом ограничения скорости воздушного потока при ХОБЛ являются мелкие дыхательные пути, включая бронхи и бронхиолы с внутренним диаметром менее 2 мм.
В норме мелкие бронхи создают небольшой процент общего сопротивления (рис. 3), однако при ХОБЛ сопротивление периферических дыхательных путей примерно удваивается. Объемная скорость газового потока обратно пропорциональна сопротивлению. В соответствии с законом Пуазейля (объемная скорость потока прямо зависит от радиуса трубки в четвертой степени), сопротивление обратно пропорционально четвертой степени радиуса трубки. Даже небольшое изменение внутреннего диаметра мелких бронхов будет приводить к значительному приросту сопротивления. Например, удвоение сопротивления мелких бронхов будет наблюдаться при уменьшении внутреннего диаметра с 2 мм до 1,6-1,7 мм. А при уменьшении диаметра с 2 мм до 1 мм сопротивление дыхательных путей возрастет в 16 раз.
При обструктивном поражении периферических дыхательных путей уменьшается скорость экспираторного воздушного потока, так как даже в норме сопротивление дыхательных путей на выдохе возрастает и существует ограничение максимального экспираторного потока.
Деструкция паренхимы (эмфизема) играет меньшую роль в необратимом компоненте обструкции по сравнению с ремоделированием мелких бронхов. Разрушение контактов альвеолярных стенок и мелких бронхов снижает способность мелких бронхов поддерживать свою проходимость. Альвеолярная деструкция также приводит к потере эластической тяги легких, что снижает внутриальвеолярное давление во время выдоха и приводит к экспираторному коллапсу бронхиол.

Рисунок 3. Изменение сопротивления дыхательных путей в
зависимости от их уровня [5]
Трахея – уровень “0”. От центральных дыхательных путей к периферическим показатель уровня (генерации) возрастает. При спокойном носовом дыхании нос оказывает около 50% общего сопротивления. При дыхании через рот на глотку и гортань приходится около 25% общего сопротивления, на долю внутригрудных дыхательных путей (трахеи, долевые и сегментарные бронхи) приходится 20% сопротивления, остальные 5% падают на мелкие бронхи и бронхиолы с диаметром менее 2 мм. Хотя площади поперечного сечения каждого из периферических путей малы, их огромное количество дает большую площадь поперечного сечения и меньшее сопротивление.
Спазм гладкой мускулатуры бронхов, воспаление дыхательных путей и скопление слизи и плазменного экссудата в просвете бронхов определяют небольшую часть ограничения скорости воздушного потока, которая обратима под влиянием лечения. Воспаление и скопление экссудата становятся особенно важными факторами значительного усугубления бронхиальной обструкции во время обострения.
Лучше всего ограничение скорости воздушного потока измеряется с помощью спирометрии, которая является ключевым моментом в диагностике и лечении ХОБЛ. Наиболее важными спирометрическими показателями для диагностики и мониторирования ХОБЛ являются объем форсированного выдоха за 1-ю секунду (ОФВ1) и форсированная жизненная емкость легких (ФЖЕЛ). По мере прогрессирования болезни и нарастания обструктивных нарушений, ОФВ1 и ФЖЕЛ снижаются. Часто первым признаком развития ограничения скорости воздушного потока является снижение отношения ОФВ1 к ФЖЕЛ. С возрастом наблюдается естественное медленное снижение ОФВ1 (не влияющее на здоровье человека), однако степень этого снижения у больных ХОБЛ значительно выше, чем в норме.
Последствия ограничения скорости экспираторного потока проявляются снижением форсированных показателей выдоха: ОФВ1 и ФЖЕЛ. По мере развития ограничения скорости воздушного потока скорость опорожнения легких замедляется, и интервалы между вдохами не позволяют выдохнуть воздух до объема релаксации дыхательной системы; это ведет к динамической гиперинфляции легких или формированию воздушных ловушек [6]. При небольшой бронхиальной обструкции эти ограничения функционально проявятся только при максимальной физической нагрузке. По мере прогрессирования бронхиальной обстрѓкции динамическая гиперинфляция будет появляться при меньшей физической нагрузкн. Гиперинфляция приводит к снижению инспираторной емкости и увеличению функциональной остаточной емкости (ФОЕ) легких, в результате появляются одышка и ограничение переносимости физической нагрузки. Повышение ФОЕ может нарушать функцию респираторных мышц и их координацию, хотя сократимость диафрагмы при нормализации объема легких остается сохранной. В настоящее время считают, что гиперинфляция развивается уже на ранних стадиях заболевания и служит основным механизмом появления одышки при нагрузке у пациентов с ХОБЛ.
На ранних стадиях заболевания одышка проявляется только при интенсивной физической нагрузке, однако при прогрессировании нарушений легочной механики начинает наблюдаться и в покое.
Бронхолитики, действующие на периферические бронхи, уменьшают выраженность воздушных ловушек, тем самым уменьшая легочные объемы, улучшают симптомы и переносимость физической нагрузки. Поэтому бронхолитики показаны даже на ранних стадиях ХОБЛ, когда динамическая гиперинфляция проявляется только при максимальной физической нагрузке.
ХОБЛ имеет различное течение заболевания, однако общим является прогрессирование ХОБЛ с неуклонным снижением ОФВ1 (рис. 4).
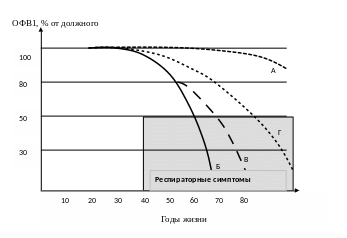
Рисунок 4. Кривые снижения ОФВ1 при различном течении ХОБЛ
А – кривая нормального возрастного снижения ОФВ1; Б – снижение ОФВ1 при быстром прогрессировании ХОБЛ: выраженные симптомы появятся в 50 лет (при снижении ОФВ1 менее 50%), тяжелая дыхательная недостаточность, требующая длительной кислородотерапии в 55 лет (при снижении ОФВ1 менее 30%); В – замедление прогессирующего падения ОФВ1, если пациент бросает курить в I стадии ХОБЛ; Г – снижение ОФВ1 при медленном прогрессировании ХОБЛ.
Прекращение влияния факторов риска, особенно курения, даже если имеется значительное ограничение скорости воздушного потока, может привести к некоторому улучшению функции легких и, безусловно, замедлит или даже остановит прогрессирование болезни. Однако развившуюся ХОБЛ и связанные с ней сопутствующие заболевания нельзя полностью устранить, и, следовательно, они требуют постоянной терапии.
Нарушения газообмена
При клинически значимых формах заболевания периферическая обструкция, деструкция паренхимы и нарушения легочного кровотока уменьшают способность легких к газообмену, что приводит к гипоксемии и позже к гиперкапнии. Вначале гипоксемия возникает только при физической нагрузке, по мере прогрессирования заболевания она наблюдается также и в покое. При ОФВ1 менее 30% обычно возникает тяжелая гипоксемия в покое (парциальное давление кислорода в артериальной крови (РаО2) менее 55 мм рт. ст.), которая приводит к нарастанию легочной вазоконстрикции, полицитемии, формированию легочного сердца и правожелудочковой недостаточности. Такая гипоксемия должна корригироваться длительной домашней кислородотерапией.
Нарушения газообмена при ХОБЛ обусловлены несколькими механизмами. Неравномерность вентиляционно-перфузионного отношения (VA/Q) – важнейший механизм развития гипоксемии при ХОБЛ. Основной вклад в развитие гипоксемии вносят регионы легких с низким VA/Q отношением (перфузируемые, но не вентилируемые альвеолы): венозная кровь недостаточно артериализируется и, смешиваясь с кровью, оттекающей от вентилируемых участков, создает так называемое венозное примешивание к артериальной крови.
Деструкция легочной паренхимы при развитии эмфиземы уменьшает диффузионную способность легких и ведет к усугублению гипоксемии.
При тяжелом заболевании хроническая гиперкапния обычно отражает дисфункцию дыхательных мышц и альвеолярную гиповентиляцию.
Гипоксемия и гиперкапния вносят важный вклад в развитие одышки при ХОБЛ, однако корреляционные связи между значениями РаО2, парциальным давлением углекислого газа в артериальной крови (РаСО2) и выраженностью одышки слабые. В подтверждение этому можно привести хорошо известный пример с больными ХОБЛ: “синие отечники” (пациенты с преимущственной бронхиальной обструкцией) имеют выраженные нарушения газообмена, но одышка у них выражена меньше по сравнению с “розовыми пыхтельщиками” (пациенты с преимущественной эмфиземой легких), у которых газообмен относительно сохранен.
Важным клиническим признаком гипоксемии является цианоз. Цианоз отражает тяжесть гипоксемии и появляется при повышении концентрации восстановленного гемоглобина более 5 г/дл, т.е. обычно при РаО2 менее 60 мм рт.ст. и сатурацией артериальной крови (SaO2) менее 90% (при нормальном уровне гемоглобина). Маркерами хронической гипоксемии при ХОБЛ являются вторичная полицитемия и легочная артериальная гипертензия.
В таблице 8 представлены положительные и отрицательные эффекты компенсаторных реакций на хроническую гипоксемию.
Основными клиническими проявлениями гиперкапнии (РаСО2 более 45 мм рт.ст.) являются гемодинамические эффекты (тахикардия, повышение сердечного выброса, системная вазодиляция) и эффекты со стороны центральной нервной системы (хлопающий тремор, бессонница, частые ночные пробуждения, сонливость днем, головная боль по утрам, тошнота). При быстром повышении РаСО2 возможно развитие гиперкапнической комы, что связано с повышением мозгового кровотока, внутричерепного давления и развитием отека головного мозга. Быстрое нарастание гиперкапнии возможно у наиболее тяжелых больных с ХОБЛ, которые склонны к накоплению СО2 при неправильно проводимой кислородотерапии (при большой скорости подачи кислорода). При развитии тяжелой гиперкапнии основным методом коррекции является вспомогательная вентиляция легких (инвазивная или неинвазивная).
Таблица 8. Положительные эффекты и отрицательные последствия компенсаторных реакций на хроническую гипоксемию
Компенсаторные реакции |
Положительные эффекты |
Отрицательные эффекты |
Активация дыхательного центра и увеличение работы внешнего дыхания |
Увеличение вентиляции, повышение РаО2 и снижение РаСО2 |
Повышение вентиля-ционной нагрузки на аппарат дыхания и утомление дыхательной мускулатуры |
Тахикардия и повышение сердечного выброса |
Повышение транспорта кислорода |
Усугубление легочной гипертензии, прогрессиро-вание сердечной недостато-чности |
Гипоксическая констрикция легочных сосудов |
Улучшение соотношения VА/Q и увеличение РаО2 |
Развитие легочной гипертензии |
Увеличение выработки эритропоэтина с развитием эритроцитоза |
Увеличение транспорта кислорода |
Повышение вязкости крови, нарастание легочной гипертензии, повышеѽме тромботического риска |
“Золотым стандартом” оценки газовых нарушений при ХОБЛ является анализ газов артериальной крови. Это исследование рекомендуется проводить всем больным с ХОБЛ при ОФВ1 менее 50%0или при появлении клинических0признаков дыхателќной недостаточности. Косвенно тяжесть гипоксемии может быть оценена по насыщению аштериальной крови кислородом, которое может быть измерено неинвазивно при помощи пульсоксиметра (SpO2). На рисунке 5 представлена кривая диссоциации окёигемоглобина, где показана зависимость SaO2 от РаО2. Достоинством пульсоксиметрии является неограниченное число измерений в любых условиях (дома, в поликлинике, в стационаре). Пульсоксиметрия используется для длительного мониторинга оксигенации больных с ХОБЛ.
SaO2,
%
ДН III
ДН II
ДН I
норма
РаО2, мм рт. ст.

Рисунок 5. Кривая диссоциации оксигемоглобина. Классификация
дыхательной недостаточности в зависимости от РаО2 и SaO2
Гиперсекреция слизи и дисфункция ресничек
Гиперсекреция слизи, приводящая к хроническому продуктивному кашлю, является характерной особенностью хронического бронхита и не обязательно сочетается с ограничением скорости воздушного потока. Напротив, симптомы гиперсекреции слизи обнаруживаются не у всех пациентов с ХОБЛ. Если гиперсекреция имеется, она обусловлена метаплазией слизистой с увеличением количества бокаловидных клеток и размеров подслизистых желез в ответ на хроническое раздражающее действие на дыхательные пути сигаретного дыма и других вредных агентов. Гиперсекрецию слизи стимулируют различные медиаторы и протеиназы. Ресничатый эпителий претерпевает плоскоклеточную метаплазию, что ведет к нарушению мукоцилиарного клиренса.
Легочная гипертензия и легочное сердце
Легочная гипертензия развивается на поздних стадиях ХОБЛ, обычно после развития тяжелой гипоксемии (РаО2<менее 60 мм рт. ст.) и часто также гиперкапнии. Это приводит к развитию хронического легочного сердца (ХЛС) с плохим прогнозом.
Основным механизмом легочной гипертензии при ХОБЛ является гипоксическая вазоконстрикция легочных сосудов (рефлекс Эйлера-Лильестранда). Такая реакция легочных артериол способна уменьшить нарушения вентиляционо-перфузионных отношений и поддержать уровень РаО2. Адекватная коррекция тяжелой гипоксемии кислородотерапией может предотвратить формирование легочной гипертензии при ХОБЛ. При отсутствии коррекции гипоксемии в дальнейшем развиваются структурные изменения легочных сосудов: гиперплазия интимы, гипертрофия/гиперплазия гладкомышечного слоя, - и легочная гипертензия становится необратимой. В сосудах отмечается воспалительная реакция, сходная с реакцией в дыхательных путях, и дисфункция эндотелия. Обеднение легочного капиллярного кровотока при эмфиземе также может способствовать повышению давления в легочной артерии.
Прогрессирующая легочная гипертензия может приводить к гипертрофии и дилатации правого желудочка и в итоге к правожелудочковой недостаточности (легочному сердцу). Правожелудочковая недостаточность приводит к застою в большом круге кровообращения и повышает риск венозных тромбозов и тромбоэмболии легочной артерии, ухудшающих легочную циркуляцию.
Системные проявления
У пациентов с тяжелой ХОБЛ начинают развиваться системные проявления, которые оказывают выраженное влияние на выживаемость пациентов и развитие сопутствующих заболеваний. Системные проявления ХОБЛ: кахексия, потеря мышечной массы, остеопороз, депрессия, повышение уровня С-реактивного белка и связанного с ним сердечно-сосудистого риска.
ПАТОМОРФОЛОГИЯ И ПАТОФИЗИОЛОГИЯ
ПРИ ОБОСТРЕНИИ
Обострения представляют собой дальнейшее усиление воспалительной реакции в дыхательных путях пациентов с ХОБЛ; причиной развития обострений могут являться бактериальные или вирусные инфекции или поллютанты окружающей среды. Механизмы воспалительного процесса, участвующие в развитии обострений ХОБЛ, недостаточно изучены. При легких и среднетяжелых обострениях отмечается увеличение в мокроте и бронхиальной стенке количества нейтрофилов и эозинофилов. Это увеличение сопровождается повышением концентраций определенных медиаторов, в том числе TNF-α, LTB4 и IL-8. Во время обострения отмечается усиление выраженности гиперинфляции и воздушных ловушек в сочетании со сниженным экспираторным потоком, что приводит к усилению одышки. Кроме того, выявляется усугубление дисбаланса VA/Q, что приводит к тяжелой гипоксемии. Усиление воспалительного ответа в бронхах при обострении ХОБЛ приводит к нарастанию бронхиальной обструкции, для пациентов с исходно тяжелой и крайнетяжелой ХОБЛ даже небольшое нарастание обструкции при обострении может привести к развитию острой дыхательной недостаточности с тяжелой гипоксемией. Усиленный воспалительный ответ в бронхах при обострении ХОБЛ эффективно подавляется системными глюкокортикоидами, несмотря на то, что часть обострений обусловлены бактериальной или вирусной инфекцией.
