
- •Глава 1. Определение, эпидемиология и социально-экономическая значимость хронической обструктивной болезни легких
- •Глава 2. Факторы риска
- •Глава 3. Патогенез, патоморфология и патофизиология
- •Бронхиальная астма хобл
- •В оспаление Поражение мелких бронхов Деструкция паренхимы
- •Ограничение скорости выходящего воздушного потока
- •Глава 4. Клиническая диагностика
- •Глава 5. Лечение
- •5.1. Введение
- •5.2. Уменьшение воздействия факторов риска
- •5.3. Лечение хронической обструкивной болезни
- •5.4. Диагностика и лечение обострений
- •I. Патогенез симптомов
- •II. Синдромы
- •Синдром эмфиземы легких (гипервоздушности легочной ткани).
- •Синдром поражения бронхов.
- •Синдром хронической дыхательной недостаточности.
- •Синдром легочной гипертензии.
- •Синдром поражения миокарда (гипертрофия и дилатация правого желудочка и правого предсердия).
- •Синдром хронической правожелудочковой недостаточности.
- •III. Диагноз
- •IV. Оценка результатов дополнительного обследования.
- •V. Лечение
- •Список использованной литературы
- •Список рекомендуемой литературы основная литература
- •Дополнительная литература
Бронхиальная астма хобл
 Сенсибилизирующий
агент Патогенный
агент
Сенсибилизирующий
агент Патогенный
агент


Воспаление дыхательных Воспаление дыхательных
путей, характерное для БА путей, характерное для ХОБЛ
CD4+ T-лимфоциты CD8+ T-лимфоциты
Эозинофилы Макрофаги, нейтрофилы
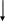

Полностью Ограничение скорости Не полностью
обратимое воздушного потока обратимое
Схема 1. Особенности воспаления в дыхательных путях
при бронхиальной астме и ХОБЛ
Таблица 5. Различия в воспалительном поражении легочной ткани при ХОБЛ и бронхиальной астме
|
ХОБЛ |
БА |
Тяжелая БА |
Клетки |
Нейтрофилы++ Макрофаги++ CD8+ Т-лимфоциты |
Эозинофилы++ Макрофаги+ CD4+ Т-лимфоциты |
Нейтрофилы+ Макрофаги CD4+, CD8+ Т- лимфоциты |
Медиаторы |
IL-8 TNF-α, IL-1β, IL-6 NO+ |
Эотаксин IL-4, IL-5, IL-13 NO+++ |
IL-8 IL-5, IL-13 NO++ |
Локализация поражения |
Проксимальные и периферические дыхательные пути Паренхима легких Легочные сосуды |
Периферические дыхательные пути |
Проксимальные и периферические дыхательные пути |
Последствия |
Плоскоклеточная метаплазия Метаплазия слизистой Фиброз мелких бронхов Деструкция паренхимы Ремоделирование легочных сосудов |
Ранимость эпителия Метаплазия слизистой Утолщение базальной мембраны Бронхоконстрикция |
|
Ответ на лечение |
Незначительный ответ на бронхолитики Плохой ответ на стероиды |
Выраженный ответ на бронхолитики Хороший ответ на стероиды |
Менее выраженный ответ на бронхолитики Сниженный ответ на стероиды |
ПАТОМОРФОЛОГИЯ
Характерные для ХОБЛ патоморфологические изменения обнаруживают в проксимальных дыхательных путях, периферических дыхательных путях, паренхиме легких и легочных сосудах (табл. 6, рис. 2). Эти патологические изменения включают признаки хронического воспаления в разных отделах легких, а также структурные изменения, обусловленные чередованием процессов повреждения и восстановления. В целом воспалительные и структурные изменения увеличиваются со степенью тяжести заболевания и сохраняются даже после прекращения курения.
Таблица 6. Патоморфологические изменения при ХОБЛ
Проксимальные дыхательные пути (трахея, бронхи с внутренним диаметром >2 мм) Воспалительные клетки: повышенное количество макрофагов, T-лимфоцитов CD8+ (цитотоксические), небольшое количество нейтрофилов. Структурные изменения: повышенное количество бокаловидных клеток, гипертрофия подслизистых желез (обе особенности ведут к гиперсекреции слизи), плоскоклеточная метаплазия эпителия. |
Периферические дыхательные пути (бронхи и бронхиолы с внутренним диаметром <2 мм) Воспалительные клетки: повышенное количество макрофагов, T-лимфоцитов (CD8+ > CD4+) и B-лимфоцитов, лимфоидные фолликулы, повышенное количество фибробластов, небольшое количество нейтрофилов. Структурные изменения: утолщение стенки бронхиол, перибронхиальный фиброз, воспалительный экссудат в просвете бронха, сужение бронхиол (обструктивный бронхиолит). |
Паренхима легких (респираторные бронхиолы и альвеолы) Воспалительные клетки: повышенное количество макрофагов и T-лимфоцитов CD8+. Структурные изменения: разрушение альвеолярной стенки, апоптоз эпителиальных и эндотелиальных клеток. • Центрилобулярная эмфизема: дилатация и разрушение респираторных бронхиол, чаще всего выявляемые у курильщиков. • Панацинарная эмфизема: разрушение альвеолярных мешочков, а также респираторных бронхиол; обнаруживаются при дефиците α1-антитрипсина. |
Легочные сосуды Воспалительные клетки: повышенное количество макрофагов и T-лимфоцитов. Структурные изменения: утолщение интимы, дисфункция эндотелиальных клеток, гипертрофия гладкомышечных клеток→легочная гипертензия. |

Рисунок 2. Патологические изменения периферических бронхов
при ХОБЛ [4]
Гистологические срезы периферических бронхов пациентов-курильщиков: А – почти нормальный бронх; Б – пробка слизистого экссудата в просвете бронха, признаки воспаления стенки незначительны; В – воспалительный экссудат в стенке и просвете бронха; Г – бронх с суженным просветом, структурной реорганизацией стенки, увели-ченным гладкомышечным слоем и отложением перибронхиальной соединительной ткани.
Различные патологические изменения в проксимальных дыхательных путях ответственны за симптомы хронического кашля и продукции мокроты, но не вызывают значимой бронхиальной обструкции, и могут наблюдаться как у пациентов с хроническим бронхитом, так и у пациентов с ХОБЛ.
Раннее снижение легочной функции при ХОБЛ коррелирует с воспалительными изменениями в периферических дыхательных путях, подобными тем, которые возникают в центральных отделах: экссудат и клетки в стенке бронхов и просвете бронхиального дерева, бокаловидная и плоскоклеточная метаплазия эпителия, отек слизистой в результате воспаления, гиперсекреция слизи в связи с увеличением числа бокаловидных клеток. Однако наиболее характерным изменением периферических дыхательных путей у больных с ХОБЛ является сужение бронхов (обструктивный бронхиолит). Воспаление инициируется табачным дымом и другими факторами риска, что ведет к повторяющимся эпизодам повреждения и регенерации бронхиальной стенки. Повреждение является следствием как прямого воздействия токсических частиц и газов, которые содержит табачный дым, так и непрямого действия воспалительных медиаторов; за повреждением следует процесс восстановления. Нарушенная регенерация ведет к ремоделированию ткани бронха c нарушением его структуры и функции. Даже нормальные восстановительные процессы могут вести к ремоделированию, так как тканевая регенерация в легких, так же как и в других органах, может вызывать рубцевание. Процесс повреждение–восстановление приводит к структурному ремоделированию стенки бронха с увеличением содержания коллагена и образованием тканевого рубца, что сужает просвет и вызывает необратимую бронхиальную обструкцию. Периферические пути являются основным местом обструкции при ХОБЛ, а структурные изменения в стенке бронха являются наиболее важной причиной повышения периферического сопротивления дыхательных путей. Воспалительные изменения, такие как отек и гиперсекреция слизи, также вносят вклад в обструкцию при ХОБЛ, как и потеря эластической тяги, однако фиброз мелких бронхов играет наиболее важную роль в этом процессе.
Первичным механизмом деструкции паренхимы и развития эмфиземы при ХОБЛ, связанного как с курением, так и с дефицитом α-1 антитрипсина, является дисбаланс эндогенных протеиназ и антипротеиназ в легких.
ПАТОФИЗИОЛОГИЯ
Ограничение скорости воздушного потока и воздушные ловушки (гиперинфляция). Ограничение скорости потока выдыхаемого воздуха является наиболее ярким патофизиологическим изменением при ХОБЛ. Это ограничение является в основном необратимым с небольшим обратимым компонентом. В таблице 7 и на схеме 2 приведены ведущие патологические изменения, приводящие к ограничению скорости воздушного потока и нарушению функции легких.
Таблица 7. Причины ограничения скорости воздушного потока при ХОБЛ
Необратимые |
Обратимые |
Фиброз и сужение бронхов (ремоделирование). Потеря эластической тяги легких и альвеолярной поддержки мелких бронхов, что приводит к раннему закрытию дыхательных путей на выдохе. |
Воспаление в дыхательных путях, накопление слизи и экссудата в бронхах. Спазм гладкой мускулатуры бронхов. Динамическая гиперинфляция при физической нагрузке (воздушные ловушки). |
