
- •Билет № 11
- •Получение
- •Качественный анализ
- •Доброкачественность
- •Количественное определение
- •Применение, хранение.
- •2. Натрия тетраборат. Представьте полную характеристику лекарственного средства, используя приведенный алгоритм.
- •Получение
- •Подлинность
- •Доброкачественность
- •Количественное определение
- •Применение. Хранение.
Получение
Н3ВО3: получают разложением буры горячим раствором НСl:
Na2B4O7 10H2O + 2 НСl 4 Н3ВО3 + 2 NaСl + 5 H2O
Борную кислоту фильтруют и проводят перекристаллизацию из воды.
Na2B4O7: получают из минерала сассолин Н3ВО3:
t0
4 Н3ВО3 + Na2СО3 Na2B4O7 + CО2 + 6 H2O
Водный раствор буры концентрируют и получают кристаллический порошок.
Подлинность
Н3ВО3: 1) Образование борноэтилового эфира, который горит пламенем, окаймленным зеленым цветом:
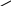
 ОН
ОС2Н5
ОН
ОС2Н5

 В
– ОН + 3 С2Н5ОН
+ H2SO4(к.)
В ―ОС2Н5
+ 3 Н2О
В
– ОН + 3 С2Н5ОН
+ H2SO4(к.)
В ―ОС2Н5
+ 3 Н2О
ОН ОС2Н5
2) Реакция с куркумином (кристаллическое вещество желто-оранжевого цвета в спирте): на куркумовую бумагу помещают раствор препарата и НСl, образуется розовая окраска, которая при прибавлении аммиака становится зеленой, а затем черной.

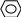
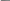
 OCH3
OCH3
OCH3
OCH3


 OH
HO – C – CH = CH– ― OH HO
O – C – CH = CH― ―OH
OH
HO – C – CH = CH– ― OH HO
O – C – CH = CH― ―OH
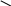


 B
OH + CH →
B CH
B
OH + CH →
B CH
OH O = C – CH = CH– – OH HO O = C – CH = CH― ―OH
—OCH3 —OCH3
куркумин розоцианин
3) + ализарин красный S + НСl → желтое окрашивание
Na2B4O7 · 10 H2O: 1) Общие фармакопейные реакции на Na+ в ОФС ГФ.
2) Na2B4O7 + HCl H3BO3 затем проводят все реакции на борную кислоту.
Доброкачественность
H3BO3: 1) допустимы: Cl-, SO42-, Ca2+, Fe , т.м., As.
2) недопустимы: минеральные кислоты: препарат растворяют в воде при нагревании,
раствор охлаждают, осадок фильтруют, к фильтрату прибавляют 1 каплю метилового оранжевого; раствор не должен быть розового или оранжевого цвета. Сама кислота борная не меняет окраску этого индикатора, так как очень слабая кислота.
Na2B4O7: 1) допустимы: Cl-, SO42-, Fe , As.
2) недопустимы: CO32- + HCl не должно быть пузырьков CO2 .
Количественное определение
H3BO3 : 1) Алкалиметрия, прямое титрование, среда - смесь 1:4 свежепрокипяченной воды и нейтрализованного по фенолфталеину глицерина. Индикатор – фенолфталеин.
Метод основан на кислотных свойствах растворов борной кислоты в глицерине. Если не добавлять глицерин, то щелочная реакция наступит раньше, так как борная кислота – очень слабая кислота и образующийся в процессе титрования метаборат натрия в водных растворах сильно гидролизуется с образованием щелочи:
H3BO3 + NaOH NaBO2 + 2 H2O
NaBO2 + 2 H2O H3BO3 + NaOH
Поэтому при количественном определении борной кислоты используют её способность образовывать одноосновную комплексную кислоту с глицерином. Диглицериноборная кислота – сильный электролит и точно оттитровывается щелочью.


 _
_
_
_
СН2ОН НОН2С СН2ОН НОН2С
СН – О – В – О – НС Н + + NaOH СН – О – В – О – НС Na+ + H2O
 СН2 – О О – Н2С
СН2 – О
О – Н2С
СН2 – О О – Н2С
СН2 – О
О – Н2С
Титруют при комнатной температуре, так как при температуре больше 50о С комплекс разрушается. Избыток глицерина на результаты титрования не влияет. В конце титрования добавляют дополнительную порцию глицерина, чтобы избежать гидролиза натриевой соли диглицероборной кислоты. Если розовая окраска сохранилась после добавления глицерина, то титрование заканчивают, а если окраска исчезает, то титрование продолжают.
2) Комплексонометрия, обратное титрование, среда –аммиачный буфер, избыток трилона Б оттитровывают хлоридом магния, индикатор – КХЧС.
Na2B4O7: Ацидиметрия, прямое титрование, индикатор – метиловый оранжевый. Метод основан на щелочных свойствах водных растворов буры.
Na2B4O7 + 2 HCl + 5 H2O 4 H3BO3 + 2 NaCl
