
- •17. Енергія Гіббса та напрямленість процесів.
- •18. Швидкість хімічної реакції та чинники, що впливають на неї (закон дії мас, правило Вант-Гоффа, рівняння Арреніуса).
- •19. Ланцюгові реакції. Каталіз і каталізатори.
- •20. Хімічна рівновага. Принцип Ле Шательє.
- •21. Загальні положення про хімічний зв'язок.
- •22. Ковалентний зв'язок: механізм утворення, основні характеристики.
- •23. Йонний зв'язок. Поняття про електронегативність.
- •24. Водневий зв'язок. Значення у природі. Металічний зв'язок.
17. Енергія Гіббса та напрямленість процесів.
Для оцінки можливості перебігу хімічного процесу треба розглянути такі термодинамічні функції, як ентропія і енергія Гіббса.
Ентропія S – це функція стану, яка характеризує ступінь неупорядкованості системи (кількісна міра хаосу) і є критерієм спрямування процесів в ізольованих системах.
Процеси, що збільшують невпорядкованість в системі, а саме випаровування, плавлення, сублімації, супроводжуються зростанням ентропії, >0. Процеси конденсації, кристалізації, фільтрації супроводжуються зменшенням ентропії, <0. Ентропія газового стану більше ентропії рідкого, а ентропія рідкого – більше ентропії твердого стану: Sг > Sp > Sт.
Ентропію реакції можна визначити як різницю між сумою ентропій продуктів реакції та сумою ентропій вихідних речовин, помножених на відповідні стехіометричні коефіцієнти .
Енергія Гіббса є критерієм напрямку перебігу процесу в неізольованих системах за умов сталої температури і тиску. Величина енергії Гіббса пов’язана з ентальпією та ентропією співвідношенням:
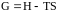 .
.
Зміна енергії Гіббса у процесах, що відбуваються за сталих тиску і температури, визначається рівнянням:
 .
.
Якщо
 0
– процес самодовільний, якщо
=0,
то система перебуває у стані рівноваги,
якщо
0
– процес неможливий. Розглянемо
зміну ентальпії, ентропії та енергії
Гіббса на прикладі процесу перетворення
води з твердого стану (лід) у рідкий. Цей
процес перетворення відбувається з
поглинанням теплоти, тобто є ендотермічним
(
0
– процес самодовільний, якщо
=0,
то система перебуває у стані рівноваги,
якщо
0
– процес неможливий. Розглянемо
зміну ентальпії, ентропії та енергії
Гіббса на прикладі процесу перетворення
води з твердого стану (лід) у рідкий. Цей
процес перетворення відбувається з
поглинанням теплоти, тобто є ендотермічним
(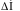 >0).
Тому ентальпійний чинник
спрямовує процес у бік утворення льоду.
Проте рідка вода має більш невпорядковану
структуру, більшу ентропію, і тому
ентропійний чинник (
>0).
Тому ентальпійний чинник
спрямовує процес у бік утворення льоду.
Проте рідка вода має більш невпорядковану
структуру, більшу ентропію, і тому
ентропійний чинник (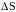 >0)спрямовує
процес у бік утворення рідини. Отже,
ентальпійний та ентропійний чинники
діють у протилежних напрямках, тому для
визначення напрямку процесу треба
визначити знак
,
який буде залежати від температури. За
достатньо високих температур ентропійний
чинник буде визначальним,
>0)спрямовує
процес у бік утворення рідини. Отже,
ентальпійний та ентропійний чинники
діють у протилежних напрямках, тому для
визначення напрямку процесу треба
визначити знак
,
який буде залежати від температури. За
достатньо високих температур ентропійний
чинник буде визначальним,
 .
У цьому разі
>0,
тому
.
У цьому разі
>0,
тому
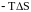 <0,
0,
процес перетворення рідини на лід
самодовільний. За низьких температур,
навпаки, член
має невеликі значення, тому
<0,
0,
процес перетворення рідини на лід
самодовільний. За низьких температур,
навпаки, член
має невеликі значення, тому
 .
В цьому випадку перетворення льоду на
рідину самодовільно не відбувається,
але може відбуватися зворотний процес
– перетворення рідини на лід. За певної
температури
.
В цьому випадку перетворення льоду на
рідину самодовільно не відбувається,
але може відбуватися зворотний процес
– перетворення рідини на лід. За певної
температури
 , ентальпійний та ентропійний чинники
врівноважуються, тобто
=0,
система перебуває у стані рівноваги.
, ентальпійний та ентропійний чинники
врівноважуються, тобто
=0,
система перебуває у стані рівноваги.
18. Швидкість хімічної реакції та чинники, що впливають на неї (закон дії мас, правило Вант-Гоффа, рівняння Арреніуса).
Залежність швидкості реакції від концентрації для елементарних (одностадійних) процесів виражається законом діючих мас: швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин, які зведені в ступінь їх стехіометричних коефіцієнтів. Так для реакції aА + bВ → dD + fF швидкість виражається кінетичним рівнянням:
 ,
,
де
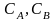 –
концентрації речовин,
–
концентрації речовин,
 – константа
швидкості, яка чисельно дорівнює
швидкості реакції, якщо концентрації
всіх реагуючих речовин дорівнюють
одиниці. Ця константа є величиною сталою
за умови сталості температури. Константа
швидкості залежить від природи речовини,
температури і не залежить від концентрації
реагуючих речовин.
– константа
швидкості, яка чисельно дорівнює
швидкості реакції, якщо концентрації
всіх реагуючих речовин дорівнюють
одиниці. Ця константа є величиною сталою
за умови сталості температури. Константа
швидкості залежить від природи речовини,
температури і не залежить від концентрації
реагуючих речовин.
У більшості випадків підвищення температури призводить до збільшення швидкості реакції. Згідно із правилом Вант-Гоффа (для невисоких та середніх температур) при підвищенні температури на кожні 100C швидкість (константа швидкості) реакції зростає в 2-4 рази. Число, яке показує в скільки разів збільшується швидкість даної реакції при збільшенні температури на 100С, називається температурним коефіцієнтом швидкості реакції γ:
 .
.
Значення температурного коефіцієнта згідно із правилом Вант-Гоффа найчастіше лежать у межах 2–4, хоча відомо багато реакцій, де цей коефіцієнт менший за 2 або більший за 4.
Якщо відома швидкість реакції при температурі Т1 і температурний коефіцієнт γ, то швидкість реакції при будь-якій температурі приблизно може бути обчислена за формулою Вант-Гоффа:
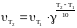 .
.
Зауважимо, що правило Вант-Гоффа є наближеним, температурний коефіцієнт можна вважати більш-менш сталим тільки у вузькому інтервалі температур. Точніше залежність швидкості від температури передають за допомогою рівняння Арреніуса:
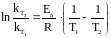 ,
,
де
 і
і
 – константи
швидкості відповідно при температурах
– константи
швидкості відповідно при температурах
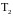 і
і
 ,
,
 – універсальна газова стала,
– універсальна газова стала,
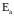 – енергія
активації. Згідно з Арреніусом у хімічну
реакцію вступають тільки ті молекули,
які мають енергію, якої достатньо для
елементарного акту реакції. Ці молекули
Арреніус назвав активними, а енергію
таких молекул –енергією активації.
– енергія
активації. Згідно з Арреніусом у хімічну
реакцію вступають тільки ті молекули,
які мають енергію, якої достатньо для
елементарного акту реакції. Ці молекули
Арреніус назвав активними, а енергію
таких молекул –енергією активації.
