
- •Содержание.
- •Ведение
- •Лекция №1 термодинамические и теплофизические свойства энергоносителей и материалов, применяемых в системах создания микроклимата в помещениях зданий.
- •1.1 Основные термодинамические понятия Параметры состояния и термодинамический процесс.
- •Первый закон термодинамики.
- •Универсальное уравнение состояния идеального газа.
- •Основные положения второго закона термодинамики.
- •Цикл и теоремы Карно.
- •Политропный процесс
- •Свойства реальных газов.
- •1.2 Термодинамические процессы водяного пара. Понятия о водяном паре
- •Процесс парообразования в координатах р—V.
- •Процесс парообразования в координатах I-s.
- •1.3 Термодинамические процессы влажного воздуха.
- •Теплофизические свойства теплоносителей. Теплоносители.
- •Санитарно-гигиенические требования к теплоносителям.
- •Экономические требования к теплоносителям.
- •Эксплуатационные показатели.
- •1.5.Теплотехнические свойства строительных материалов.
- •Пористость и объемный вес.
- •Влажность.
- •Теплопроводность.
- •Теплоемкость.
- •1.5.Заключение
- •Лекция№2: нормативная документация и терминология по климатологии, строительной теплотехнике, системам кондиционирования микроклимота.
- •2.1 Нормативная документация по микроклимату в помещениях и скм Перечень нормативных документов и область их применения.
- •СНиП 23-01-99*. “Строительная климатология”
- •Классификация помещений.
- •Параметры микроклимата.
- •2.3 Терминология и основные разделы по строительной климатологии (согласно сНиП 23-01-99*). Термины и определения
- •Расчетные параметры наружного воздуха для проектирования систем овк.
- •2.4 Терминология и основные разделы сНиП 41-01-2003. Отопление вентиляция и кондиционирование(от 1 января 2004г.) Термины и их определение.
- •Общие положения.
- •Параметры внутреннего воздуха при отоплении и вентиляции помещений.
- •Параметры микроклимата при кондиционировании помещений.
- •Параметры внутреннего воздуха в производственных помещениях с автоматизированным технологическим оборудованием.
- •Параметры внутреннего воздуха при других технологических и тепловых условиях.
- •Концентрация вредных веществ в помещениях.
- •Параметры наружного воздуха.
- •2.5 Терминология и основные разделы сНиП II-3-79*(издание 1998г). Термины, примененные в сНиП II-3-79*(ключевые слова).
- •Термины из других нормативных документов, применяемые в сНиП II-3-79* .
- •Краткое содержание.
- •Общие требования и показатели микроклимата
- •Оптимальные и допустимые нормы температуры, относительной влажности и скорости движения воздуха в помещениях жилых зданий.
- •Перечень наиболее гигиенически значимых веществ, загрязняющих воздушную среду помещений жилых зданий.
- •2.8. Заключение.
- •Лекция №3: микроклимат помещения и системы его обеспечения.
- •3.1. Теплообмен человека и условия комфортности. Понятие микроклимата и физиологические предпосылки для его создания.
- •Условия комфортности.
- •Нормативные требования к микроклимату в помещении.
- •3.2. Расчётные параметры микроклимата в помещениях.
- •3.3. Зимние и летние расчётные климатические условия для систем обеспечения микроклимата.
- •3.4 Системы создания микроклимата в помещении.
- •3.5 Заключение.
- •Лекция №4: тепловлажностный и воздушный режимы помещений.
- •4.1. Факторы, определяющие микроклимат в помещениях.
- •4.2. Особенности теплового режима здания. Назначение теплового режима.
- •Тепловые условия в помещении.
- •Теплообмен в помещении.
- •4.3. Зимний воздушно-тепловой режим помещений. Расчётные климатические условия.
- •Тепловой баланс помещений.
- •Влияние теплозащитных свойств ограждений на воздушно-тепловой режим помещения.
- •Воздухопроницаемость ограждающих конструкций и её влияние на воздушно-тепловой и влажностный режим помещения.
- •Влажность воздуха помещения и её влияние на воздушно-тепловой режим помещения.
- •4.4. Летний воздушно-тепловой режим помещений. Особенности летнего теплового режима.
- •Средства для подержания летнего теплового режима.
- •Тепловой баланс помещения в летний период года.
- •4.5. Заключение.
- •Лекция №5: теплопередача в ограждающих конструкциях здания при стационарном тепловом потоке.
- •5.1.Общие закономерности.
- •5.2.Расчёт сопротивления теплопередаче ограждений.
- •5.3. Сопротивления теплообмену и коэффициенты теплоотдаче у поверхности ограждения.
- •5.4. Термическое сопротивление ограждения.
- •5.5. Расчёт температуры в ограждении.
- •5.6. Нормирование сопротивления теплопередаче.
- •5.7. Теплоустойчивость ограждающих конструкций.
- •5.7. Заключение.
- •Лекция №6: воздухопроницание ограждающих конструкций зданий.
- •Ветровое давление.
- •Совместное действие на здание гравитационного и ветрового давлений.
- •6.2. Воздухопроницаемость материалов.
- •6.3. Воздухопроницаемость ограждений.
- •6.4. Расчёт воздухопроницания через ограждения.
- •6.5. Заключение.
- •Лекция №7: влажный воздух и его применение в системах кондиционирования микроклимата.
- •7.1. Общие сведения о влажном воздухе. Определение и область применения воздуха.
- •Состояние и состав воздуха.
- •7.2 Основные характеристики влажного воздуха Определение характеристик воздуха.
- •Средства и методы контроля влажности воздуха.
- •Значение параметра влажности воздуха как экологического показателя среды.
- •7.3 Определение параметров тепловлажностного состояния воздуха по I-d диаграмме. Принцип определения параметров воздуха по I-d диаграмме.
- •Сущность аспирационного метода определения относительной влажности.
- •Примеры построения тепловлажностностных процессов в I-d диаграмме.
- •7.4 Теплотехнические свойства влажного воздуха.
- •Теплофизические свойства сухого воздуха при нормальном атмосферном давлении *
- •7.5 Заключение.
- •Лекция 8. Влажностный режим зданий и его влияние на микроклимат в помещениях.
- •8.1 Общие понятия о влажностном режиме наружных ограждений. Предмет изучения влажностного режима наружных ограждений.
- •Значение влажностного режима наружных ограждений.
- •Причины появления влаги в наружных ограждениях.
- •8.2 Конденсация и сорбция водяного пара. Влажностные характеристики внутреннего и наружного воздуха.
- •Конденсация влаги на поверхности ограждения.
- •Меры против конденсации влаги на поверхности ограждения.
- •Сорбция и десорбция.
- •8.3 Перемещение в ограждении парообразной влаги. Физическая сущность паропроницаемости.
- •Количественные зависимости для расчета паропроницаемости.
- •8.4 Расчет влажностного режима при стационарных условиях диффузии водяного пара. Особенности расчета влажностного режима.
- •Методика расчета влажностного режима.
- •Факторы, влияющие на влажностный режим ограждения.
- •Анализ условий для просыхания ограждения.
- •Оценка результатов расчета влажностного режима.
- •Расчет влажностного режима при нестационарных условиях диффузии водяного пара.
- •8.5 Меры против конденсации в ограждениях
- •8.6 Влажностный режим бесчердачных перекрытий
- •8.7. Перемещение жидкой влаги в ограждении Механизм перемещения влаги.
- •Условия для перемещения влаги в строительных материалах.
- •8.8 Заключение
- •Лекция № 9 системы кондиционирования микроклимата в помещениях.
- •9.1. Санитарно-гигиенические основы систем кондиционирования микроклимата
- •9.2.Организация воздухообмена в помещении.
- •Понятие о способах организации воздухообмена и устройстве систем вентиляции.
- •Схемы воздухораспределения в помещениях.
- •Воздухораспределение струями.
- •9.3 Организация теплообмена в помещениях. Общие замечания.
- •9.4 Особенности и области применения систем создания микроклимата в помещениях. Назначение систем кондиционирования микроклимата в помещениях.
- •Виды и область применения систем отопления.
- •Типы и разновидности отопительных приборов.
- •9.5 Энергосбережение и микроклимат в помещении.
- •9.6.Заключение
- •Список рекомендуемой литературы.
Цикл и теоремы Карно.
Циклом Карно называется круговой цикл, состоящий из 2-х изотермических и из 2-х адиабатных процессов. Обратимый цикл Карно в p,υ- и T,s- диаграммах показан на рис. 3.1.
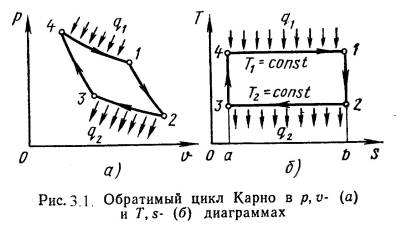
На рисунке 3.1 показаны следующие процессы:
1-2 – обратимое адиабатное расширение при s1=сonst, температура уменьшается от Т1до Т2;
2-3 – изотермическое сжатие, отвод теплоты q2 к холодному источнику от рабочего тела;
3-4 – обратимое адиабатное сжатие при s2=сonst, температура повышается от Т3 до Т4;
4-1 – изотермическое расширение, подвод теплоты q1 от горячего источника к рабочему телу. Основной характеристикой любого цикла является термический коэффициент полезного действия (т.к.п.д.):
t = Lц / Qц , (1.8)
или
t = (Q1 – Q2) / Q1 .
Для обратимого цикла Карно т.к.п.д. определяется по формуле:
tк = (Т1 – Т2) / Т1 . (1.9)
Отсюда следует 1-я теорема Карно: "Термический к.п.д. обратимого цикла Карно не зависит от свойств рабочего тела и определяется только температурами источников".
Из сравнения произвольного обратимого цикла и цикла Карно вытекает 2-я теорема Карно: "Обратимый цикл Карно является наивогоднейшим циклом в заданном интервале температур." Т.е. т.к.п.д. цикла Карно всегда больше т.к.п.д. произвольного цикла:
tк > t . (1.10)
Политропный процесс
Политропным процессом называется процесс, все состояния которого удовлетворяют условию:
P· n = Const, (4.24)
где n – показатель политропы, постоянная для данного процесса. Изобарный, изохорный, изотермический и адиабатный процессы являются частными случаями политропного процесса:
при n = ± = Const, (изохорный),n = 0 P = Const, (изобарный),n = 1 T = Const, (изотермический), n = P· = Const, (адиабатный).
Работа политропного процесса определяется аналогично как при адиабатном процессе:
l = R·(T1 – T2) / (n – 1); (4.25) l = R·T1·[1 – ( 1/ 2) n-1] /(n – 1); (4.26) l = R·T2·[1 – (P2/P1) (n-1)/ n] /(n – 1). (4.27)
Теплота процесса:
q = cn ·(T2 – T1), (4.28)
где cn = cv ·(n - )/(n – 1) – массовая теплоемкость политропного процесса.
Свойства реальных газов.
Реальные газы отличаются от идеальных газов тем, что молекулы этих газов имеют объемы и связаны между собой силами взаимодействия, которые уменьшаются с увеличением расстояния между молекулами. При практических расчетах различных свойств реальных газов наряду с уравнением состояния применяется отношение P·v/(R·T)=c, которое называется коэффициентом сжимаемости. Так как для идеальных газов при любых условиях P·v = R·T, то для этих газов с = 1. Тогда величина коэффициента сжимаемости выражает отклонение свойств реального газа от свойств идеального. Величина с для реальных газов в зависимости от давления и температуры может принимать значения больше или меньше единицы и только при малых давлениях и высоких температурах она практически равна единице. Тогда реальные газы можно рассматривать как идеальные. В связи с отличием свойств реального газа от свойств идеального газа нужно иметь новые уравнения состояния, которые связывали бы значения P, х, T и давали бы возможность рассчитывать некоторые свойства газов для разных условий. Были предложены многочисленное число различных уравнений состояния реальных газов, из которых наиболее распространены.
1)Ван-дер-Вальса для реального газа (с поправками на силы сцепления и объем молекул)
2) М.П. Вукаловича и И.И. Новикова – для водяного пара (с поправками на ассоциацию и диссоциацию молекул).
