
- •Общие правила выполнения лабораторных работ
- •Правила техники безопасности
- •Правила противопожарной безопасности
- •Первая помощь при несчастных случаях
- •Лабораторная работа № 1 Основные классы неорганических соединений.
- •Лабораторная работа №2. Химическая кинетика
- •Лабораторная работа № 3
- •I. Приготовление 100 мл раствора NaCl из более концентрированного.
- •Плотность и процентное содержание растворов NaCl.
- •Составим схему пользуясь правилом креста (правило смешения). ΩH2o принимаем равное 0.
- •Д) Определяем V 23% раствора:
- •II. Определение процентной концентрации полученного раствора NaCl.
- •III. Расчёт остальных видов концентраций полученного раствора.
- •Лабораторная работа № 4 Электролитическая диссоциация
- •Лабораторная работа № 5 Гидролиз солей. Опыт №1. Определение характера гидролиза при помощи pH – индикаторной бумаги.
- •13) Какая из перечисленных солей не подвергается гидролизу: СuSo4; Li2so4, CuCl2; BaCl2; NaH2po4; CuS.
- •14) Приведите примеры солей растворы которых будут иметь: а) кислую; б) щелочную; в) нейтральную среду.
- •Лабораторная работа № 6 Изучение окислительно-восстановительных реакций.
- •Вопросы и задачи.
- •Лабораторная работа № 7 комплексные соединения
- •Часть 11. Лабораторный практикум по неорганической химии Лабораторная работа № 1. Химия металлов главных подгрупп
- •Лабораторная работа №2 Химия неметаллов
- •Лабораторная работа №3 Химия металлов побочных подгрупп.
Лабораторная работа № 3
Приготовление растворов с заданной концентрацией.
I. Приготовление 100 мл раствора NaCl из более концентрированного.
1). Определение плотности исходного концентрированного раствора.
Налить в узкий высокий цилиндр концентрированный раствор NaCl и опустить в него ареометр, следя за тем чтобы он не прикасался к стенкам цилиндра. Отсчитать деления (с точностью до тысячных долей), до которого ареометр погрузился в раствор (отсчёт вести по нижнему мениску). Деление это покажет относительную плотность раствора ρ1.
2). Найти в таблице 1 процентное содержание NaCl (w1%), отвечающее найденной плотности r1. По той же таблице найти плотность r2 раствора который необходимо приготовить.
Таблица 1.
Плотность и процентное содержание растворов NaCl.
Концентра-ция, % (по массе) |
Плотность, г/мл, при температуре |
Концентрация, % (по массе) |
Плотность, г/мл, при температуре |
||
|
10°С |
20°С |
|
10°С |
20°С |
1 |
1,0071 |
1,0053 |
14 |
1,1049 |
1,1008 |
2 |
1,0144 |
1,0125 |
15 |
1,1127 |
1,1065 |
3 |
1,0218 |
1,0196 |
16 |
1,1206 |
1,1162 |
4 |
1,0292 |
1,0268 |
17 |
1,1285 |
1,1241 |
5 |
1,0366 |
1,0340 |
18 |
1,1364 |
1,1319 |
6 |
1,0441 |
1,0413 |
19 |
1,1445 |
1,1398 |
7 |
1,0516 |
1,0486 |
20 |
1,1525 |
1,1478 |
8 |
1,0591 |
1,0559 |
21 |
1,1607 |
1,1559 |
9 |
1,0666 |
1,0633 |
22 |
1,1689 |
1,1639 |
10 |
1,0742 |
1,0707 |
23 |
1,1772 |
1,1722 |
11 |
1,0819 |
1,0782 |
24 |
1,1856 |
1,1804 |
12 |
1,0895 |
1,0857 |
25 |
1,1940 |
1,1888 |
13 |
1,0972 |
1,0933 |
26 |
1,2025 |
1,1972 |
3). Рассчитать, какой объём концентрированного раствора нужно взять для получения 100 мл раствора заданной концентрации. Пример: Из 23% раствора с r1=1,1722 г/мл необходимо приготовить 100 мл 10% раствора с r2=1,070 г/мл.
Составим схему пользуясь правилом креста (правило смешения). ΩH2o принимаем равное 0.

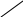 А) 23%
10 в. ч.
А) 23%
10 в. ч.
10%

0% 13 в. ч.
Б) Для приготовления 10% раствора необходимо взять 10 весовых частей концентрированного раствора NaCl (13 весовых частей воды). В итоге получим 10 в. ч. + 13в. ч. = 23 в.ч. 10% раствора NaCl.
В) Определим массу 100 мл 10% раствора m р-ра = r · Vр-ра =1,070 г/мл · 100 мл = 107,07 г.
Г) Определяем массу 23% раствора (массу, которую составляют 10 весовых частей:
23 в. ч. – 107,07 г. 10 в. ч. · 107,07 г.
 10
в. ч. – Х г. Х =
= 46,55 г.
10
в. ч. – Х г. Х =
= 46,55 г.
23 в. ч.
