
Экзаменационные задачи.
Задача №1. При определении кристаллизационной воды BaCI2•2H2O было получено 14,70% воды. Рассчитать ошибку абсолютную и относительную.
Дано: Решение:
BaCI2•2H2O
1. ω(ист
H2O)=
 H2O%
= 14,70 % 2. Δх абс.=14,75%-14,70%=0,05%
H2O%
= 14,70 % 2. Δх абс.=14,75%-14,70%=0,05%
Найти:
3. Δх отн.=
Δх
абс. - ? Ответ: Δх
абс.=0,05%; Δх отн.=
 %
%
Δх относ. - ?
Задача №2. Сколько мл. раствора КОН (ρ=1,291) требуется для приготовления 5 литров приблизительно 0,15 Н раствора.
Дано: Решение:
ρ
(КОН)=1,291 1. Vисх=
V(КОН)=5л.=5000
мл. 2. ω%=
СN=0,15
Н m(р-ра)=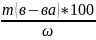
Найти:
mэ(КОН)
= =56,11г/моль
=56,11г/моль
Vисх
(КОН)-? 3. m(в-ва)= =42,08
мл.
=42,08
мл.
4. По таблице на стр.211 Ярославцева определить плотность ω=30%
m(р-ра)= =140г.
=140г.
5.
Vисх=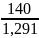 =108
мл.
=108
мл.
Ответ: Vисх=108 мл.
Задача №3. Какую навеску медного купороса CuSO4•5H2O следует взять для анализа на содержание кристаллизационной H2O.
Решение:
Хгр 0,1 гр.
CuSO4•5H2O → 5H2O
250 г/моль 5*18=90г/моль

90х=0,1•250
90х=25
х=0,3
Ответ: х=0,3 гр.
Задача №4. Рассчитать навеску известняка для анализа на содержание СО2, если образец содержит около 85% СаСО3
Решение:
Х 0,1
СаСО3→СО2
100Г/моль 44г/моль
 =
=
44х=10
х=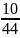 =0,23гр.
(если СаСО3
чистый)
=0,23гр.
(если СаСО3
чистый)
ωнав= =0.3
СаСО3
c
примесями
=0.3
СаСО3
c
примесями
Ответ: m(нав)=0,3гр.
Задача №5. Рассчитать навеску кристаллической соды Na2CO3•10H2O для анализа на содержание кристаллизационной воды.
Решение:
Хгр 0,1гр.
Na2CO3•10H2O→10H2O
286,14г/моль 10*18=180г/моль
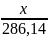 =
=
180х=286,14•0,1
Х= =0,16~0,2гр.
=0,16~0,2гр.
Ответ: х=0,2гр.
Задача №6. Какую навеску каменного угля, содержащего около 4% серы следует взять для анализа на содержание серы, если ее определяют в виде BaSO4.
Решение:
ω(S)=
 =
=
Ответ: =1,4гр.
Задача №7. Для определения содержания влаги, взята навеска хлорида натрия 0,2828г. После высушивания до постоянной массы получено 1,9918г. Рассчитать содержание влаги Х в %.
Решение:
Определяем содержание влаги в Н2О
m(Н2О)=2.0828-1.9918=0.091 г.
2.0828 - 100%
0.091-х
Х= =4,37%
=4,37%
Ответ: х=4,37%
Задача №8. Рассчитать навеску Х кристаллического хлорида магния MgCI2•6H2O для определения в нем хлора, осаждением нитратом серебра.
Решение:
Х г
MgCI2•6H2O+2AgNO3→2AgCI↓+Mg(NO3)2+6H2O
2 моль 2 моль
203 г. 287 г.
Исходное вещество MgCI2•6H2O имеет М=95+108=203 г/моль, значит m=1 моль•203 г/моль=203 г.
Осаждаемая форма AgCI имеет
М(AgCI)=143.5г/моль
Масса осадка должна быть 0,5 г.
Составляем пропорцию:
для 287 г. AgCI масса осадка 0,5 г.
203 г. MgCI2 ------ Х г.
х= =0,35
г
=0,35
г
Ответ: х=0,35 г.
Задача №9. Рассчитать количество серной кислоты, необходимой для полного осаждения бария в форме сульфата из 0,5 г. кристаллического хлорида бария.
Решение:
0.5г. Х г.
BaCI2•2H2O + H2SO4→ BaSO4↓+2HCI+2 H2O
1 моль 1 моль
М(208+36) 98 г/моль
= 244,3г/моль 98 г.
BaCI2•2H2O 244,3 г. – масса 0,5 г.
H2SO4 98 г. – Х г.
 ;
Х=0,2 г.
;
Х=0,2 г.
Ответ: Теоретическое количество H2SO4 около 0,2 г, практический берут 0,3 г.
Задача №10. Технический хлорид бария содержит около 97% BaCI2•2H2O. Какую навеску следует взять для получения 0,3 г. осадка BaSO4.
Решение:
Х г. 0,3 г.
BaCI2•2H2O + H2SO4→ BaSO4↓+2HCI+2 H2O
244,3 г 233 г.
Х= =0,31
г.
=0,31
г.
ω=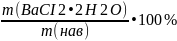
0,97=
0,97х=0,31
Х=0,32 г.
Ответ: х=0,32 г.
Задача №11. Рассчитать навеску силикатной породы, содержащей около 5% СаО, которая необходима для определения кальция в виде СаSO4, если масса осадка СаSO4=0,3 г.
Решение:
СаО – определяемая форма
СаSO4 – весовая форма
Х г. 0,3 г.
СаО→ СаSO4
56 г. 136 г.
Х=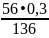 =0,124
г.
=0,124
г.
0,124 – 5%
Х – 100%
х=2,5 г.
Ответ: х=2,5 г.
