- •Химия d-элементов. Сплавы.
- •Общая характеристика переходных металлов
- •Химические свойства хрома и его соединений
- •Химические свойства молибдена и его соединений
- •Химические свойства марганца и его соединений
- •Химические свойства железа и его соединений
- •Химические свойства кобальта и его соединений
- •Сплавы и их свойства
Химические свойства кобальта и его соединений
По химической активности кобальт уступает железу. Он легко растворяется в кислотах - окислителях и медленно в обычных кислотах: Co + 4HNO3 ® Co(NO3)2 + 2NO2 + 2H2O
Co + 2HCl ® CoCl2 + H2
В простых соединениях у кобальта наиболее устойчива степень окисления +2, в комплексных – +3. Водные растворы солей кобальта (II) обычно окрашены в розовый цвет, осадки – в голубой:
CoSO4(розовый) + 2KOH = Co(OH)2¯(голубой) + K2SO4
4Co(OH)2 + 24NH3 + 2H2O + O2 = 4[Co(NH3)6](OH)3
Химические свойства элементов IВ группы
|
Эл. конф. |
r, г/см3 |
t°пл. °C |
t°кип.°C |
ЭО |
АР |
СО |
Cu |
[Ar] 3d104s1 |
8,96 |
1083 |
2595 |
1,9 |
0,127 |
+1,+2 |
Ag |
[Kr] 4d105s1 |
10,5 |
960 |
2180 |
1,9 |
0,144 |
+1,+2 |
Au |
[Xe]4f145d106s1 |
19,3 |
1064 |
2700 |
2,4 |
0,144 |
+1,+3 |
Физические свойства
1. Высокие значения плотности, температур плавления и кипения.
2. Высокая тепло- и электропроводность.
Химические свойства
Малоактивные металлы. Активность уменьшается сверху вниз по группе.
Все металлы IB группы стоят в ряду напряжений после водорода.
Взаимодействуют с неметаллами при высоких температурах:
2Cu + O2 –t→ 2CuO
2Ag + S –t→° Ag2S
Золото реагирует только со фтором: 2Au + 3F2 = 2AuF3
Т.к. эти металлы стоят в ряду напряжений правее водорода, то они не реагируют с разбавленными соляной и серной кислотами, но растворяется в кислотах – окислителях:
Cu + 4HNO3(конц.) →Cu(NO3)2 + 2NO2 + 2H2O
2Ag + 2H2SO4(конц.) →Ag2SO4 + SO2 + 2H2O
Золото растворяется только в царской водке, селеновой кислоте и влажном хлоре:
2Au + 7H2SeO4 = 2H[Au(SeO4)2] + 3SeO2 + 6H2O
Также все металлы в присутствии O2 растворяются в растворе цианидов (а Cu и в р-ре NH3):
4Au + 8NaCN + 2H2O + O2 = 4Na[Au(CN)2] + 4NaOH
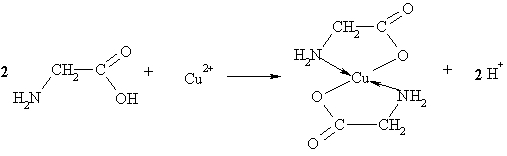
4Cu + 8NH3 + 2H2O + O2 = 4[Cu(NH3)2]OH
Соединения Cu(I) легко диспропорционируют: 2CuCl = Cu + CuCl2
Устойчивы только в виде комплексных соединений (к.ч. = 2): CuCl + 2NH3 = [Cu(NH3)2]Cl
В степени окисления +2 соединения меди проявляют амфотерные свойства:
Основные: Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Кислотные: Cu(OH)2 + 2KOH(конц.) = K2[Cu(OH)4]
В высших степенях окисления – Cu(II), Ag(I), Au(III) - проявляют окислительные свойства:
2CuSO4 + 4KI = 2CuI¯ + I2 + 2K2SO4
Для двухвалентной меди характерны аквакомплексы, аминокомплексы, ацидокомплексы и хелатные комплексы с координационными числами 4 и 6.
|
Химические свойства элементов IIВ группы
|
Эл. конф. |
r, г/см3 |
t°пл. °C |
t°кип.°C |
ЭО |
АР |
СО |
Zn |
[Ar] 3d104s2 |
7,10 |
420 |
907 |
1,6 |
0,133 |
+2 |
Cd |
[Kr] 4d105s2 |
8,65 |
321 |
765 |
1,7 |
0,149 |
+2 |
Hg |
[Xe]4f145d106s2 |
13,55 |
-39 |
357 |
1,9 |
0,160 |
+1,+2 |
Физические свойства
1. Высокие значения плотности, аномально низкие температуры плавления и кипения.
2. Высокая тепло- и электропроводность
3. Мягкие металлы.
Химические свойства
Активность уменьшается сверху вниз по группе.
Все металлы IIB группы проявляют степень окисления +2, их соединения, в-основном, не окрашены Þ проявляют свойства непереходных элементов.
Цинк и кадмий – металлы средней активности. При нагревании реагируют с неметаллами:
2Zn + O2 –t°→ 2ZnO
Cd + Cl2 –t°→ CdCl2
Цинк – амфотерный металл:
Zn + 2HCl –t°→ ZnCl2 + H2
Zn + 2NaOH + 2H2O –t°→ Na2[Zn(OH)4] + H2
Для дегазации ртути используются следующие химические реакции:
Hg + S = HgS
2Hg + 2FeCl3 = Hg2Cl2 + 2FeCl2 Также ртуть можно собрать с помощью медной пластинки (образуется нелетучая амальгама меди).
Соединения Hg(I) – неустойчивы и легко диспропорционируют:
Hg2Cl2 –t°→ Hg + HgCl2
каломель сулема