
- •25 Лекция 12. Метод динамического рассеяния света лекция 12. Метод динамического рассеяния света Рассеяние в условиях гауссовой и негауссовой статистики
- •Динамическое рассеяние света как спектроскопия очень высокого разрешения
- •Флуктуации и временные корреляционные функции
- •Измерение динамической составляющей рассеянного света
- •Коэффициенты диффузии, вычисляемые из динамической составляющей рассеяния света
- •Динамическое рассеяние света в условиях гауссовой статистики
- •Частицы, размеры которых малы по сравнению с длиной волны света
- •Жесткие частицы, размеры которых сравнимы с длиной волны света
- •Гибкие частицы, размеры которых сравнимы с длиной волны света
- •Электрофоретическое рассеяние света
- •Рассеяние и флуоресценция в условиях малого числа частиц Рассеяние малым числом частиц
- •Кросс-корреляция (метод двух детекторов).
- •Рассеяние одной частицей
- •Флуоресцентная корреляционная спектроскопия
- •Различные виды движений
Флуоресцентная корреляционная спектроскопия
Флуоресцентная корреляционная спектроскопия может рассматриваться как ветвь динамического рассеяния в негауссовых условиях эксперимента, поскольку флуоресценция является фундаментально некогерентным явлением. ФКС является методом, в котором интенсивность флуоресценции, исходящая от небольшого числа флуоресцентных молекул в очень малом объеме, коррелируется для получения информации о процессах, которые вызывают флуктуации флуоресценции. Одним из важных процессов, который приводит к стохастическому появлению и исчезновению флуоресценции в малом наблюдаемом объеме, является их броуновское движение. Относительная амплитуда флуктуации обратно пропорциональна числу одновременно наблюдаемых молекул. Поэтому присутствие большого числа молекул в макроскопической среде, подавляет эффект таких флуктуаций. Этот простой аргумент показывает, что для ФКС-измерений желательно наличие в микрообъеме очень небольшого числа интенсивно светящихся молекул.
Основные принципы метода ФКС продемонстрированы на рисунке 32.4. Флуктуации сигнала флуоресценции вызываются или диффузией флуоресцирующих молекул через объем, или изменением сигнала во времени из-за химических реакций. По записанному сигналу флуктуации флуоресценции (горизонтальные стрелки) вычисляется автокорреляционная функция (вертикальные стрелки). Из функции автокорреляции могут быть получены среднее время жизни (τср) и число молекул (N) в объеме. По этим данным и размеру флуоресцирующего объема, можно определить коэффициент диффузии D флуоресцирующей молекулы. Значение D может быть использовано для оценки формирования молекулярных комплексов, поскольку коэффициент диффузии частицы в изолированном состоянии (закрашено зеленым) будет больше, чем коэффициент диффузии молекулярного комплекса (закрашено красным и зеленым цветом) (см. рис. 32.4).
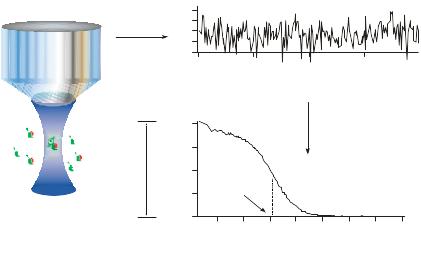
Рис. 32.4. Основные принципы ФКС (см. текст) (см. картинку из нейрофизиологии)
Если мы определим отклонение мгновенного значения от среднего как
![]() (32.6),
(32.6),
то в результате ряда преобразований получаем:
![]() (32.9)
(32.9)
Величину![]() принято
называть «флуктуацией», поскольку она
определяет отклонение свойства от
среднего.
принято
называть «флуктуацией», поскольку она
определяет отклонение свойства от
среднего.
Различные виды движений
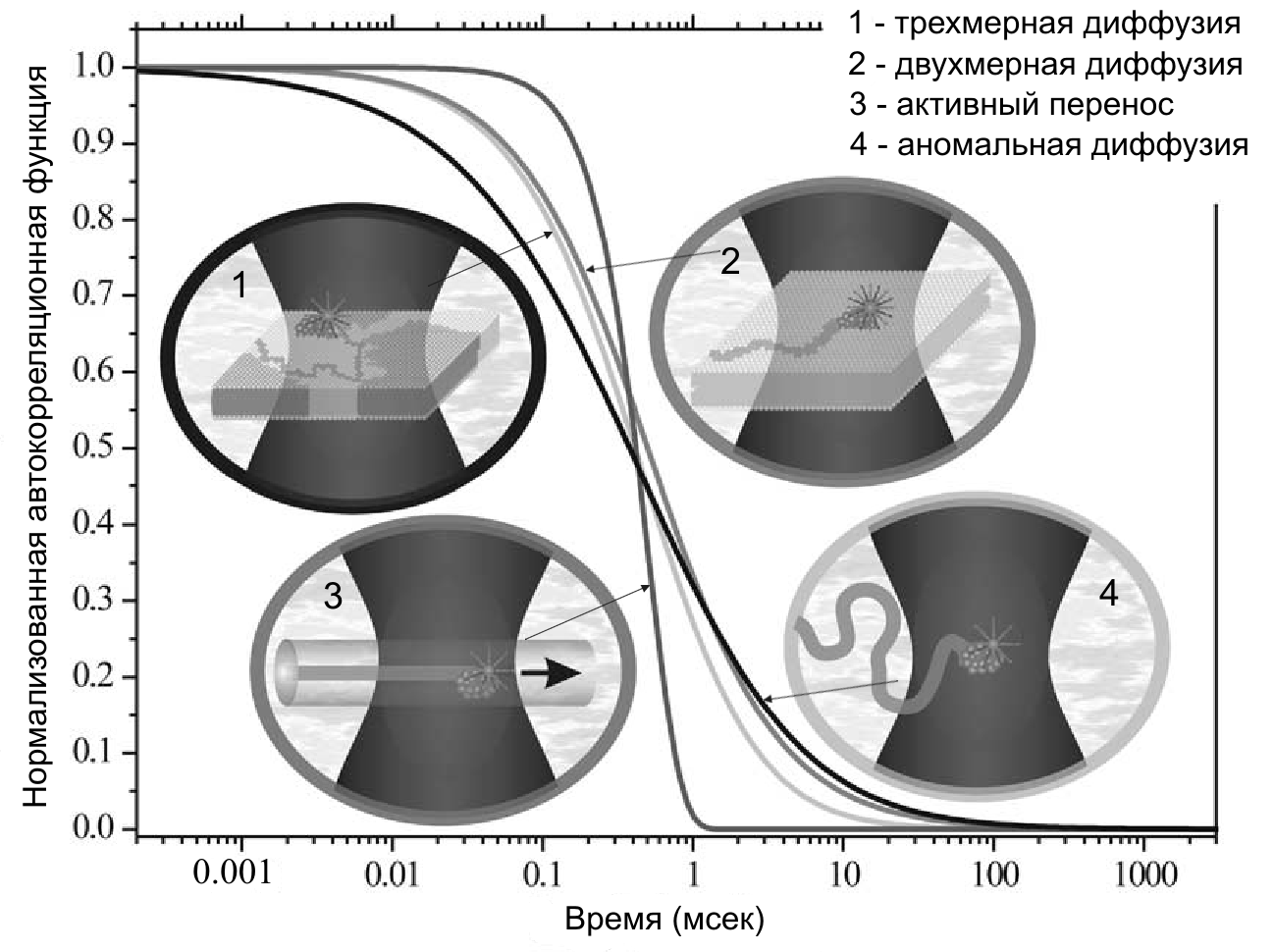
Рис. 32.5. Модельная автокорреляционная кривая для частиц с различной подвижностью: (1) трех- и (2) двухмерная диффузия, (3) активный транспорт и (4) аномальная диффузия (см. текст) (Hausten и Schwille, 2003)
Биологические макромолекулы в клетке находятся в условиях, далеких от таковых в разбавленных растворах. Поэтому коэффициенты диффузии, описывающие их поведение в клетке, сильно отличны от таковых, рассмотренных нами в Лекции 22. Кривые модельных корреляционных функций, показывающие различные способы движения биологических макромолекул, приведены на рисунке 32.6. Из рисунка видно, что корреляционная функция для активного транспорта имеет самый крутой спад, в то время как кривая для аномальной диффузии уменьшается довольно медленно. Частицы, диффундирующие внутри биологической мембраны, могут демонстрировать большое разнообразие видов движения, в зависимости от локального окружения для каждого индивидуального хромофора.
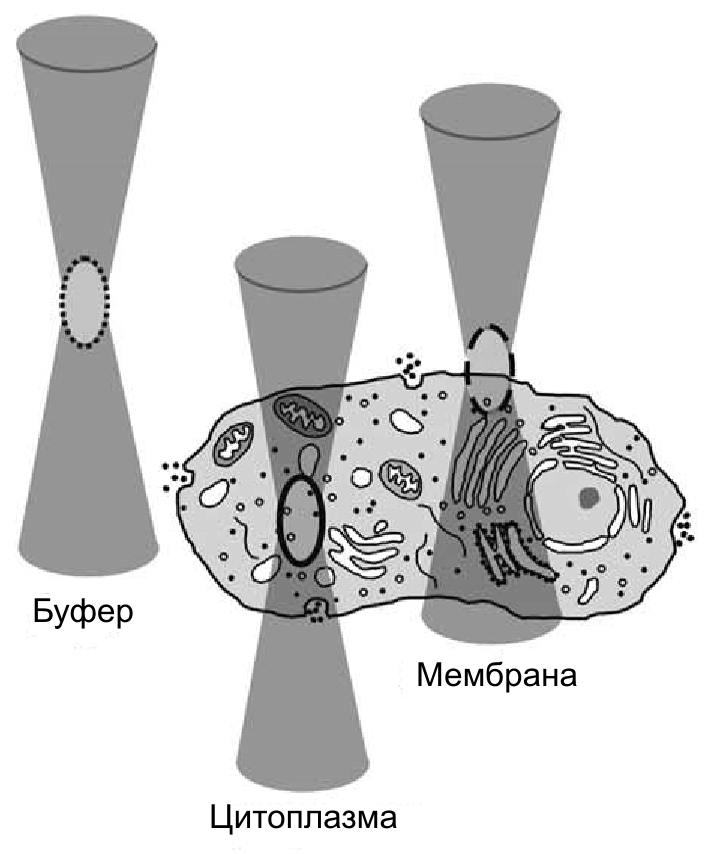
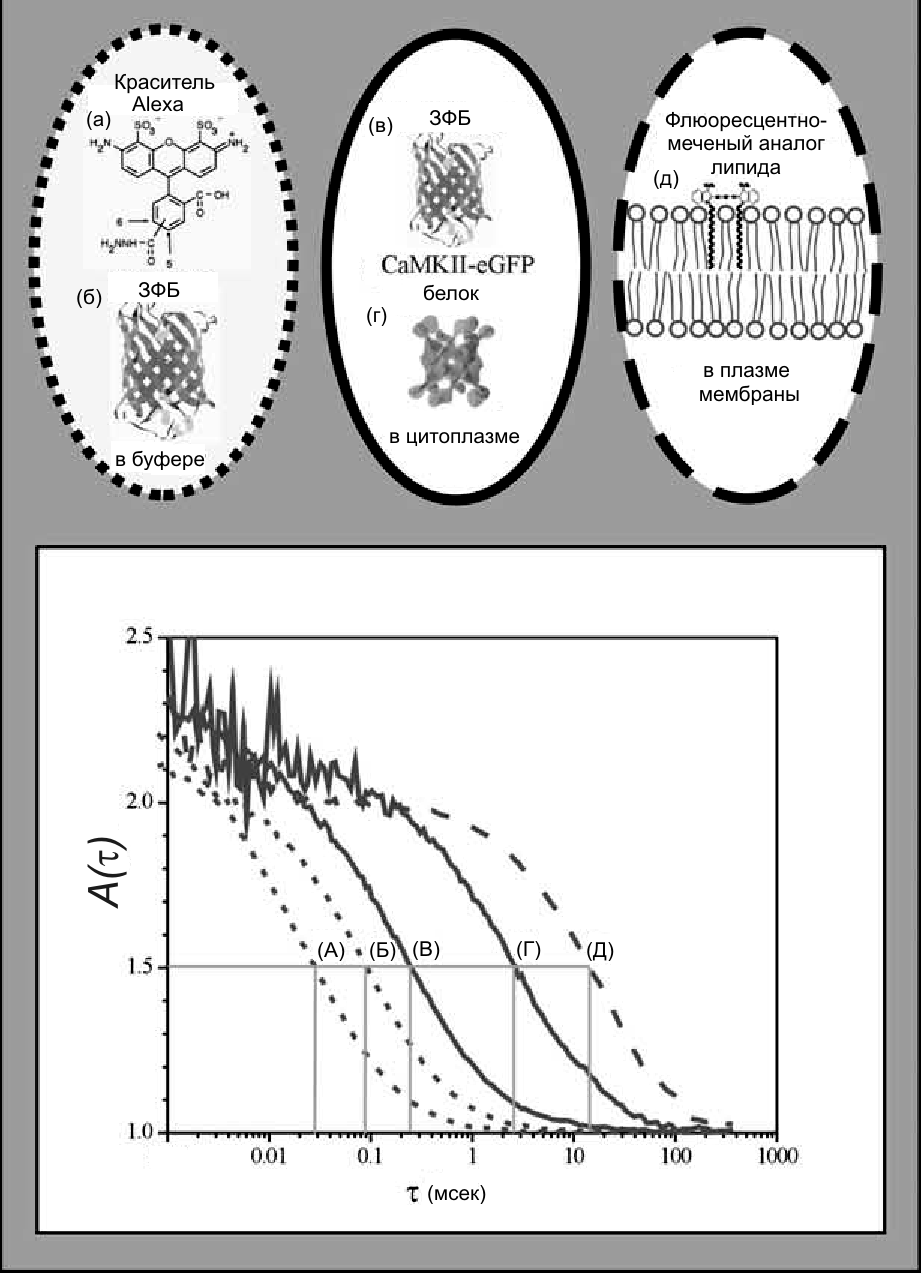
Рис. 32.6. Описание различных видов динамического движения in vitro и in vivo при помощи корреляционных функций. Фокальный объем, который приблизительно равен 0.2 фемтолитра, может быть наблюдаем как вне клетки (в чистом буфере), так и внутри неё (в цитоплазме или в плазме клеточной мембраны).
Рис. 32.7. Коэффициенты диффузии для различных биологических макромолекул в разном окружении: (а) маленькая молекула красителя (Alexa 488, M ~ 0.6 кДa) в воде, D = 3×10−6 см2·сек-1; (б) зеленый флуоресцирующий белок (eGFP) в водном растворе (M ~ 27 кДa) D = 9×10−7 см2·сек-1); (в) этот же белок в цитоплазме клеток М-HeLa D = 3×10−7 см2 сек−1; (г) большой белковый комплекс (калмодулин-зависимая киназа II и eGFP белок) в цитоплазме клеток линии HEK, D = 3×10−8 см2·сек−1; (д) двумерная диффузия флуоресцирующего зонда (длинная цепь карбоцианинового красителя «dif C18’») в плазме мембраны клеток линии HEK -, D = 6×10−9 см2 ·сек−1 (Bacia and Schwille, 2003)
