
- •Малюгина о.В. Лекция 7. Состав атома. Элементарные частицы.
- •Донорно-акцепторная связь
- •3.2.2.1. Свойства ковалентной связи
- •Скорость химической реакции
- •Окислительно-восстановительные реакции
- •Содержание
- •Описание[править | править исходный текст]
- •Окисление[править | править исходный текст]
- •Восстановление[править | править исходный текст]
- •Окислительно-восстановительная пара[править | править исходный текст]
- •Виды окислительно-восстановительных реакций[править | править исходный текст]
- •Примеры[править | править исходный текст]
- •Окисление, восстановление[править | править исходный текст]
- •§2.5. Электронное строение атома.
- •§1.2 Предмет химии. Физические и химические превращения.
- •§3.2 Ковалентная связь. Понятие о полярной ковалентной и ионной связи.
- •Ковалентной связью называется связывание атомов с помощью общих (поделенных между ними) электронных пар.
- •§4.2. Периодическая таблица элементов.
- •Горизонтальные строчки Периодической таблицы называются периодами, а вертикальные - группами.
- •Номер периода, в котором находится элемент, совпадает с номером его валентной оболочки. Эта валентная оболочка постепенно заполняется от начала к концу периода.
- •Каждый период Периодической таблицы начинается активным металлом и заканчивается инертным газом.
- •Номер группы совпадает с числом валентных электронов, которые могут участвовать в образовании химических связей.
- •Заряд ядра z совпадает с порядковым номером элемента в Периодической таблице.
- •§3.1 Разновидности химических связей.
- •§3.3 Валентность. Молекулярные формулы.
- •Гидролиз солей[править | править исходный текст]
- •Степень гидролиза[править | править исходный текст]
- •Константа гидролиза[править | править исходный текст]
Малюгина о.В. Лекция 7. Состав атома. Элементарные частицы.
Вначале ХХ века английский физик Эрнест Резерфорд предложил планетарную модель строения атома. Атом любого химического элемента сравнивался с Солнечной системой: в центре – массивное ядро, вокруг которого вращаются (как планеты) электроны, каждый по своей траектории.
Оказалось, что крошечное ядро, в котором сосредоточена вся масса атома, состоит из двух видов частиц – протонов и нейтронов.
Рис. 1. Элементарные частицы, входящие в состав атома
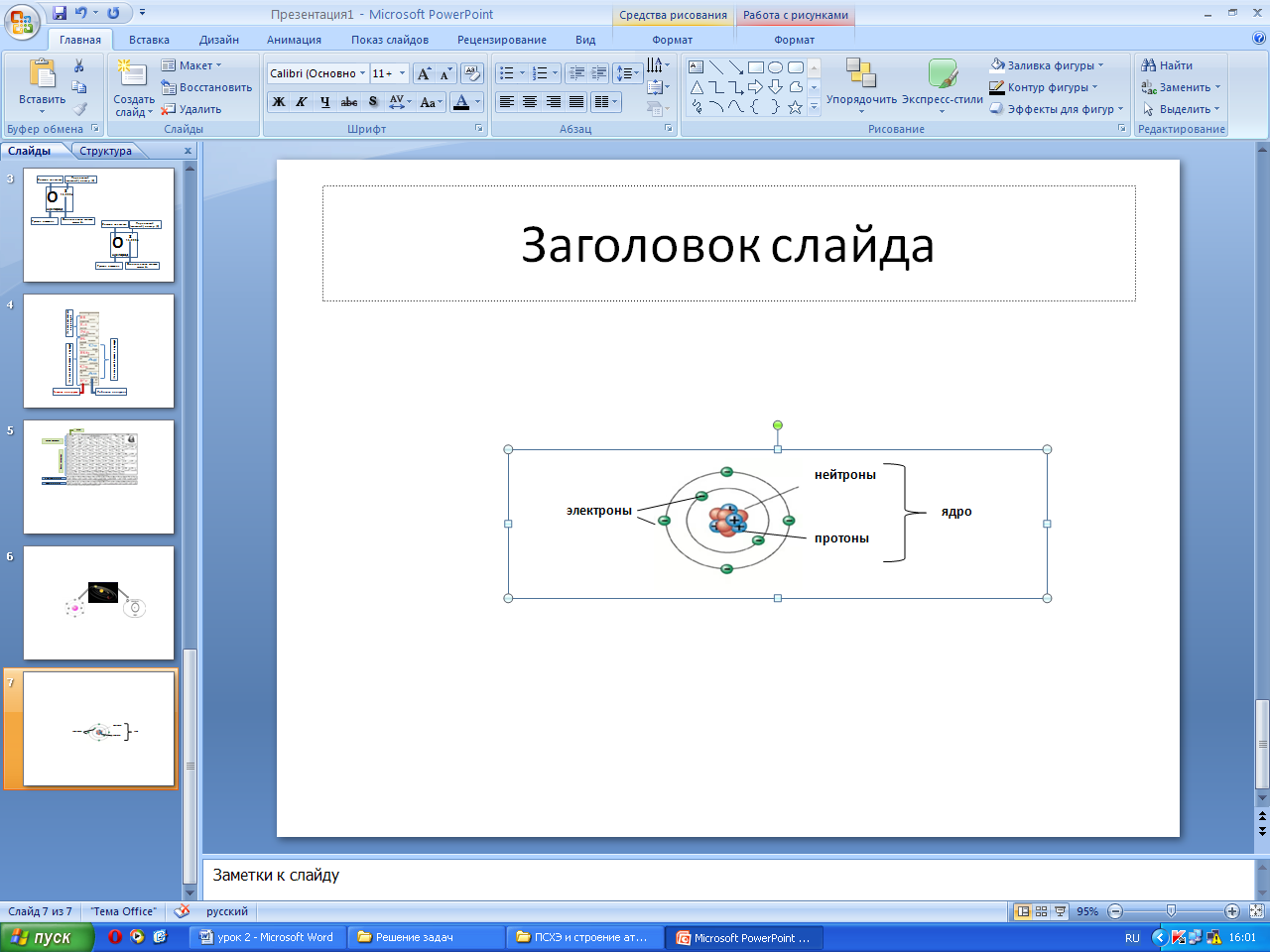
Электроны
– крошечные частицы, заряд которых
принят равным «-1», а масса, равная ![]() массы атома водорода, прията равной
нулю.
массы атома водорода, прията равной
нулю.
Протоны имеют заряд равный заряду электрона, но противоположный по знаку (+1), и массу, равную массе атома водорода (принята равной 1).
Нейтроны – нейтральные частицы, которые не несут заряда. Масса нейтрона равна массе протона, то есть 1.
Из вышесказанного следует, что:
Ядро атома имеет положительный заряд, равный числу протонов.
Масса атома равна сумме протонов и нейтронов (эту сумму назвали массовым числом). Массой электрона принято пренебрегать вследствие ее чрезвычайно малой величины.
Число протонов равно числу электронов, т.к. атом – электронейтральная (не имеющая заряда) частица.
Дальнейшие исследования строения атомов показали, что количество элементарных частиц можно вычислить, исходя из положения химического элемента в периодической системе следующим образом:
заряд ядра = числу протонов = порядковому номеру химического элемента в периодической системе
число электронов = числу протонов
число нейтронов = массовое число – число протонов
В таблице 1 обобщена вся информация об элементарных частицах.
Таблица 1. Основные характеристики элементарных частиц.
Название частицы |
Характеристика частицы |
Обозначение |
Место нахождение |
Примечание |
|
Заряд |
масса |
||||
Протон |
+1 |
1 а.е.м |
р+ |
в ядре атома |
Число протонов = номеру элемента = заряду атомного ядра |
Нейтрон |
0 |
1 а.е.м |
n0 |
в ядре атома |
Число нейтронов находят по формуле: N = A - Z |
Электрон |
-1 |
а.е.м.
Принята равной 0 |
е- |
образуют электронную оболочку |
Число электронов = порядковому номеру элемента = числу протонов = заряду атомного ядра |
Используемые обозначения:
Z – порядковый номер элемента
A – массовое число
N - число нейтронов
Вопросы для самоконтроля.
В какой части атома сосредоточена практически вся его масса?
Из каких элементарных частиц состоит атом?
Какие частицы входят в состав ядра атома?
Какой заряд имеет ядро атома?
Чем определяется величина заряда атомного ядра?
Какие элементарные частицы, входящие в состав атома, имеют заряд?
Какие элементарные частицы, входящие в состав атома, имеют массу 1 а.е.м?
Массой каких элементарных частиц, входящих в состав атома, пренебрегают?
Какие элементарные частицы, входящие в состав ядра атома, не несут заряда?
Какую величину называют массовым числом?
Как обозначают массовое число атома?
Что обозначают буквой Z, описывая состав атома?
Какую величину обозначают буквой N, описывая состав атома?
Чему равно число протонов в ядре атома?
Чему равно число электронов в атоме?
Как вычислить количество нейтронов?
Почему атом – электронейтральная частица?
Чему равны относительные массы протона, нейтрона и электрона?
Почему заряд ядра атома равен числу протонов?
Посмотреть ответ
В ядре.
Из протонов, нейтронов и электронов.
Протоны и нейтроны.
Положительный, равный порядковому номеру элемента.
Числом протонов.
Протоны (+1) и электроны (-1).
Протоны и нейтроны.
Электронов.
Нейтроны.
Сумму протонов и нейтронов.
Буквой А.
Порядковый номер химического элемента в периодической системе.
Число нейтронов.
Число протонов = порядковому номеру элемента = заряду атомного ядра.
Число электронов = порядковому номеру элемента = числу протонов = заряду атомного ядра.
Число нейтронов находят по формуле: N = A – Z, где
Потому что в атоме число протонов = числу электронов.
Массы протона и нейтрона равны 1, масса электрона в 2000 раз меньше.
Потому, что заряд протона равен «+1»
Типовая задача 1. Определить число элементарных частиц (протонов, нейтронов и электронов в атоме)?
Для решения задачи рассмотрим атом хлора, имеющий массу (массовое число) 35, пользуясь периодической системой химических элементов.
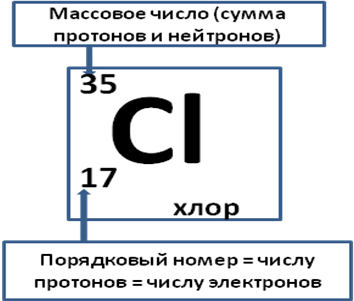
Число протонов равно 17
Число нейтронов равно 18 (N = A – Z; N = 35-17 = 18)
Число электронов = 17
Запишем состав атома хлора: [{17 р+; 18 n0} 17 е-]
ядро электронные оболочки
Задания для самостоятельного решения:
Подсчитать число элементарных частиц ( протонов, нейтронов и электронов) и записать состав атомов: 11В, 23Na, 27Al, 31P, 19F, 65Zn
Чему равен заряд ядра и число электронов в атомах следующих элементов: углерод, сера, медь, барий, серебро?
Назовите элемент, в ядре которого содержится 11 протонов.
Назовите элемент, в атоме которого содержится 26 электронов.
Сколько электронов и протонов входит в состав атома элемента, который находится: а) в V периоде, побочной подгруппе VI группы б) в IV периоде, главной подгруппе II группы?
Посмотреть ответ:
11В: [{5 р+; 6 n0} 5 е-]
23Na: [{11 р+; 12 n0} 11 е-]
27Al: [{13 р+; 14 n0} 13 е-]
31P: [{15 р+; 16 n0} 15 е-]
19F: [{9 р+; 10 n0} 9 е-]
65Zn: [{30 р+; 35n0} 30 е-]
2. |
Символ элемента |
C |
S |
Cu |
Ba |
Ag |
|
Порядковый номер |
6 |
16 |
29 |
56 |
47 |
|
Заряд ядра |
+6 |
+16 |
+29 |
+56 |
+47 |
|
Числе электронов |
6е- |
16е |
29е- |
56е |
47е- |
3. Количество протонов = порядковому номеру элемента (Z). Атом имеет Z=11, это натрий.
4. Количество электронов = порядковому номеру элемента (Z). Атом имеет Z=26, это железо.
5. |
Условия (координаты клетки) |
Порядковый номер |
Число протонов |
Число электронов |
|
V период, побочная подгруппа VI группы |
40, цирконий |
40 р+ |
40 е- |
|
IV период, главная группа II группы; |
20 кальций |
20 р+ |
20 е- |
