
- •1. Наглядные пособия:
- •2. Литература:
- •Учебные материалы
- •Распространение в природе
- •Биологическое значение
- •Применение в медицинской практике
- •Раствор иода спиртовой 5%
- •Кислота хлористоводородная
- •Лекарственные вещества - производные гагогенводородиых кислот
- •Получение
- •Методы количественного определения
- •Лабораторная работа Фармацевтический анализ лекарственного вещества VII группы периодической системы д.И. Менделеева
- •Натрия хлорид
- •Раствор йода спиртовой 5%
- •Натрия бромид
- •Натрия иодид
- •Калия хлорид
- •Калия бромид
- •Калия иодид
Методы количественного определения
Общим официнальным методом количественного определения лекарственных веществ этой группы (кроме натрия фторида) является аргентометрия - метод осадительного титрования, основанный на образовании труднорастворимых галогенидов серебра.
В зависимости от условий, в которых проводится определение, различают несколько вариантов аргентометрии, но ни в одном из них не ведут титрование в щелочной среде, т.к. щелочи разлагают титрант с образованием осадка гидроксида серебра белого цвета, который подстепенно разлагается

Вариант (метод) Мора - прямое титрование, среда нейтральная или слабощелочная, индикатор - калия хромат. Обе реакции - основная и индикации, основаны на осаждении, но поскольку растворимость галогенидов серебра меньше, чем хромата серебра, то в первую очередь идет осаждение анализируемого вещества, а затем реакция индикации.
По варианту Мора рекомендуется определять хлориды и бромиды (натрия и калия бромиды; натрия и калия хлориды); иодиды этим методом не определяют вследствие сильной адсорбции иодидов на осадке серебра иодида; маскировки образующегося в точке эквивалентности осадка серебра хромата окраской осадка серебра иодида из-за чего становится сложно заметить переход окраски в конце титрования
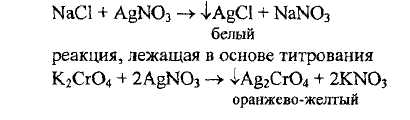
В кислой среде титрование по варианту Мора невозможно потому, что в результате смещения равновесия в растворе между ионами, содержащими хром (VI), в кислой среде будут находиться дихромат-ионы, с которыми катион серебра труднорастворимого соединения не образует
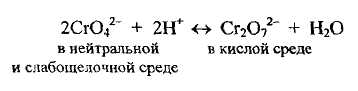
Вариант Фаянса - прямое титрование галогенидов в уксуснокислой среде в присутствии индикаторов адсорбционного типа. Индикаторы в этом методе — красители, являющиеся слабыми кислотами или их солями (Hind, Nalnd), диссоциирующие в водных растворах с образованием окрашенного аниона
![]()
который в определенный момент адсорбируется на осадке галогенида серебра и окрашивает его.
В этом варианте аргентометрии используется свойство коллоидных частиц осадка галогенида серебра, например AgCl адсорбировать на своей поверхности прежде всего одноименные ионы (Ag+ и СГ), находящиеся в растворе над осадком. При этом, до достижения точки эквивалентности в растворе находятся хлорид-ионы, которые, адсорбируясь на поверхности осадка AgCl, придают ему отрицательный заряд. В точке эквивалентности, когда все хлорид-ионы будут осаждены, поверхность осадка не заряжена. При добавлении одной избыточной капли титранта AgNOj в растворе появляются одноименные с осадком катиона - Ag+, которые адсорбируясь на его поверхности придают ему положительный заряд. Именно тогда в качестве про-тивоионов на осадке адсорбируются окрашенные анионы индикатора, которые и придают ему характерную окраску.
Свойство адсорбироваться на поверхности осадка после достижения точки эквивалентности является основным требованием к индикатору адсорбционного типа.
Согласно ФС, титрование с адсорбционным индикатором эози-натом натрия рекомендуется для натрия и калия йодидов. При титровании с этим индикатором йодидов (среда уксуснокислая) происходит изменение окраски осадка от желтой до розовой.
Этот индикатор применим и при титровании бромидов, но не применим при определении хлоридов, т.к. анионы индикатора адсорбируются осадком серебра хлорида до достижения точки эквивалентности.
Для хлоридов рекомендуется использовать такие адсорбционные индикаторы как бромфеноловый синий (переход от желто-зеленой окраски раствора до сине-фиолетовой окраски осадка) или флуоресцеин (в точке эквивалентности белый осадок серебра хлорида приобретает розово-красную окраску).
Метод Фольгарда применяют для количественного определения йодидов, бромидов, хлоридов.
К раствору точной массы галогенида прибавляют полуторный или двукратный избыток титрованного раствора нитрата серебра, 5 мл разведенной азотной кислоты, 10—20 капель индикатора
(железоаммониевых квасцов) и титруют избыток нитрата серебра раствором роданида аммония до буровато-оранжевого окрашивания раствора над осадком:
KJ + AgNO3 → AgJ | + КNO3;
AgNO3 + NH4SCN → AgSCN + NH4NO3;
3NH4SCN + FeNH4 (SO4)2 → Fe (SCN)3 + 2 (NH4)2 S04.
Примечание 1. При титровании хлоридов по методу Фольгарда нельзя вблизи точки эквивалентности сильно встряхивать реакционную смесь, так как вследствие меньшей величины произведения растворимости роданида серебра (»10-12) по сравнению с хлоридом серебра (»10~10) может произойти частичное превращение хлорида серебра в роданид серебра, в результате чего будут получены заниженные результаты. Для уменьшения контакта осадка хлорида серебра с роданид-ионами можно также прибавить 5—10 мл органического растворителя — ксилола или толуола, которые обволакивают поверхность осадка хлорида серебра.
Примечание 2. При наличии в лекарственной смеси нескольких галогенидов методом Фольгарда определяется сумма всех галогенидов.
Примечание 3. Рассмотренные официнальные методы аргентометрии представлены в таблице 4.
Неофицинальные методы количественного определения. Метод Кольтгофа, основанный на осаждении серебра иодида в сернокислой среде, прямое титрование; в качестве индикатора используется иодкрахмальный комплекс, образуемый в анализируемом растворе путем добавления раствора калия иодата (1 капля 0,1 моль/л раствора), кислоты серной разбавленной и крахмала.
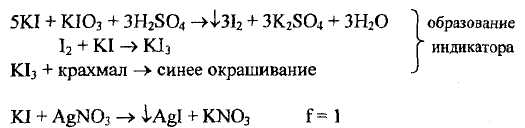
В точке эквивалентности, когда все иодид-ионы из анализируемого раствора будут осаждены, лишняя капля серебра нитрата связывает иодид-ионы, находящиеся в составе йодкрахмального комплекса и синяя окраска раствора исчезает. Метод является селективным для йодидов и используется при их количественном определении в присутствии других галогенид-ионов.
Меркуриметрия. Метод титриметрического анализа, основанный на образовании малодиссоциируемых - в случае хлоридов или бромидов или труднорастворимых - в случае иодидов, галогенидов ртути.
В качестве титрантов используются ртути нитрат или ртути перхлорат. Титрование прямое, среда азотнокислая. При анализе хлоридов и бромидов в качестве индикатора используется дифенилкарбазон, образующий в точке эквивалентности с ионами ртути (II) комплексное соединение, окрашенное в розовато-фиолетовый цвет.
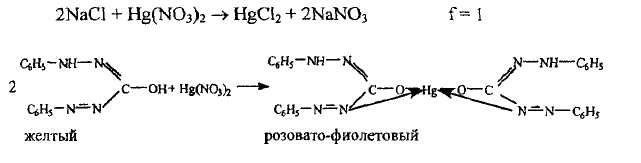
В случае титрования йодидов образуется труднорастворимое соединение - ртути йодид, имеющий ярко-красную окраску
![]()
Окраска осадка маскирует окраску индикатора, установление конца титрования затруднено, поэтому при анализе йодидов в анализируемый раствор добавляют спирт этиловый, в котором осадок растворим. Соотношение водной и спиртовой фаз должно быть 1:1 (концентрация спирта не менее 55%).
Ограничением для использования метода является высокая токсичность соединений ртути.
Броматометрия основана на окислении иодидов в сильнокислой среде до иодмонохлорида

Титрование проводят в присутствии крахмала до лимонно-желтой окраски раствора (IC1), возможно определение йодидов в присутствии других галогенидов.
Метод ионообменной хроматографии основан на обратимом обмене ионами между анализируемым раствором и ионообменным сорбентом, например, катионитом в Н-форме.
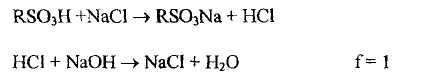
В данном варианте метода при обмене ионами образуется кислота хлористоводородная, которую затем определяют алкалиметрически. Определение методом ионообменной хроматографии относится к варианту косвенного титрования.
Ограничением метода является его длительность, использование специального оборудования - ионообменной хроматографической колонки.
Рефрактометрия. Оптический метод, основанный на свойстве света преломляться при переходе из одной среды в другую (например, из воздушной среды в анализируемый раствор).
Метод применяют в аптечной практике, он экономичен (на анализ используют 3-4 капли раствора), его отличает простота и быстрота выполнения.
Ограничением метода является его невысокая чувствительность - концентрация анализируемого вещества в растворе должна быть не менее 3%.
Количественное определение натрия фторида проводят следующими методами:
- в субстанции и таблетках определяют потенциометрически с ионселективным фторидным электродом. Содержание натрия фторида находят по калибровочному графику.
Хранение. В хорошо укупоренной таре, в сухом, защищенном от света месте; йодиды в склянках темного стекла (желтеют на свету вследствие окисления до иода).
Применение.
Калия и натрия хлориды входят в состав плазмозамещающих жидкостей, т.к. нормализуют осмотическое давление в клетках организма (калий - внутриклеточный, натрий - внеклеточный ионы).
NaCl применяют в виде изотонического раствора 0,9% внутривенно, подкожно; 3%, 5% и 10% гипертонических растворов - наружно для лечения гнойных ран, полосканий при заболевании верхних дыхательных путей, обтираний.
Калия хлорид используется при недостатке калия в организме (например, во время приема диуретиков); при нарушениях сердечного ритма внутрь, в виде 10% раствора.
Бромиды оказывают успокаивающее действие при нервных расстройствах (неврастении, бессоннице, эпилепсии и др.). Бромиды усиливают процессы торможения в коре головного мозга. Применяют в составе микстур, таблеток.
Иодиды применяют как носители иода, например, при зобе, внутрь; наружно-как противовоспалительное, например, в глазных каплях.
Формы выпуска:
субстанции;
натрия хлорид - таблетки по 0,9 г и раствор для инъекций 0,9%;
калия бромид и калия йодид в таблетках по 0,5 г;
в составе многокомпонентных растворов для инъекций (растворы: Рингера-Локка, Дисоль, Хлосоль);
натрия фторид применяют в стоматологии в виде 2% раствора;
натрия фторид выпускают в таблетках по 0,5 мг и таблетках для сосания по 0,001 г.
Таблица - 4. Методы аргентометрического титрования.
Методы титрования |
Метод Мора |
Метод Фольгарда |
Метод Фаянса |
Способ титрования |
Прямое титрование |
Обратное титрование |
Прямое титрование |
Индикатор |
K2CrO4
в КТТ образуется красный осадок Ag2CrO4 |
Fe3+: (NH4)Fe(SO4)2∙ 12H2O
в КТТ образуется красный раствор Fe(SCN)3 |
Адсорбционные индикаторы:
(рН = 6,5 – 10,3) желто-зеленый → розовый
(рН = 2,0 – 10,3) оранжево-красный → фиолетовый |
Титрант метода |
AgNO3 Стандартизация по точной навеске NaCl или KCl |
Титрованный раствор: AgNO3 (добавляется в избытке) Титрант: KSCN (NH4SCN) |
AgNO3 Стандартизация по точной навеске NaCl или KCl |
Химизм |
Г- + Ag+ = AgГ↓ |
Г- + Ag+ (избыток) = AgГ↓
Ag+ (остаток) + SCN- = AgSCN↓
|
Г- + Ag+ = AgГ↓ |
Определяемые вещества |
Cl-, Br - |
Cl-, Br -, I-, SCN-, CO32-, PO43-, S2-, CrO42-, CN-, C2O42- и т.д. |
Cl-, Br -, I-, SCN-, SeO32-, CN- |
рН титрования |
6,5 – 10,3 нейтральная и слабощелочная среда |
1 - 3 кислая среда |
нейтральная и слабокислая среда |
Особенности проведения титрования |
Комнатная температура из-за увеличения растворимости Ag2CrO4 и понижения чувствительности индикатора к Ag+
|
|
|
Недостатки метода |
|
1. большой расход титрованного раствора 2. не применяется в присутствии окислителей и солей ртути из-за разрушения SCN- ионов 3. при определении Cl- ионов осадок AgCl нужно отделить от раствора, чтобы оттитровать избыток титрованного раствора (из-за малой растворимости AgSCN↓)
|
|
Применение в фармацевтическом анализе |
анализ KCl, NaCl, KBr, NaBr |
|
|
