
- •1. Наглядные пособия:
- •2. Литература:
- •Учебные материалы
- •Распространение в природе
- •Биологическое значение
- •Применение в медицинской практике
- •Раствор иода спиртовой 5%
- •Кислота хлористоводородная
- •Лекарственные вещества - производные гагогенводородиых кислот
- •Получение
- •Методы количественного определения
- •Лабораторная работа Фармацевтический анализ лекарственного вещества VII группы периодической системы д.И. Менделеева
- •Натрия хлорид
- •Раствор йода спиртовой 5%
- •Натрия бромид
- •Натрия иодид
- •Калия хлорид
- •Калия бромид
- •Калия иодид
Лекарственные вещества - производные гагогенводородиых кислот
В медицинской практике применяются соли щелочных металлов.
Общая характеристика лекарственных веществ этой группы приведена в таблице. 2.
Таблица - 2. Названия и физико-химические свойства ЛВ -производных галогенводородных кислот.
МНН |
Латинское название |
Химическая формула |
Распространение в природе |
Описание, растворимость |
Sodium chloride
|
Natrii chloridum |
NaCl натрия хлорид
|
Галит, каменная соль NaCl |
Белые кубические кристаллы или белый кристаллический порошок, без запаха, соленого вкуса |
Potassium chloride |
Kalii chloridum |
KCl калия хлорид |
Сильвинит KCl ∙ NaCl Карналлит KCl∙MgCl2∙6H2O |
Бесцветные кристаллы или белый кристаллический порошок, без запаха, соленого вкуса. Растворим в 3 частях воды, практически нерастворим в 95% этаноле |
Sodium bromide |
Natrii bromidum |
NaBr натрия бромид |
Бромид железа (II) и железа (III) FeBr2∙2FeBr3 (Fe3Br8) |
Белый кристаллический порошок, без запаха, соленого вкуса. Гигроскопичен. Растворим в 1,5 частях воды и 10 частях спирта |
Potassium bromide |
Kalii bromidum |
KBr калия бромид |
Бромид железа (II) и железа (III) FeBr2∙2FeBr3 (Fe3Br8) |
Бесцветные или белые кристаллы или мелкокристаллический порошок, без запаха, соленого вкуса. Растворим в 1,7 частях воды, мало растворим в спирте |
Sodium iodide |
Natrii iodidum |
NaI - натрия иодид |
Иодид железа (II) и железа (III) FeI2∙2FeI3 (Fe3I8) |
Белый кристаллический порошок, без запаха, соленого вкуса. На воздухе сыреет и разлагается с выделением иода. |
Potassium iodide |
Kalii iodidum |
KI калия иодид |
Иодид железа (II) и железа (III) FeI2∙2FeI3 (Fe3I8) |
Бесцветные или белые кристаллы или мелкокристаллический порошок, без запаха, соленого вкуса. Растворим в 1,7 частях воды, мало растворим в спирте |
Sodium fluoride |
Natrii phthoridum |
NaF натрия фторид |
Флюорит, плавиковый шпат CaF2 |
Белый порошок, без запаха. Растворим в воде, практически нерастворим в этаноле |
Получение
Натрия хлорид получают из воды озер и морей выпариванием. Однако при этом остаются примеси. Сначала освобождаются от примесей - сульфаты и фосфаты осаждают из водного раствора бария или кальция хлоридом
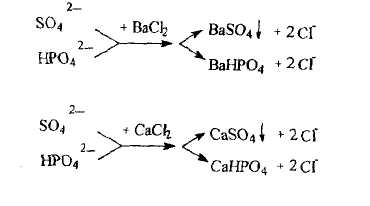
Раствор декантируют,
а примеси солей кальция, бария и магния
осаждают натрия карбонатом
Раствор отделяют
от осадка, декантируют и снова нейтрализуют
кислотой хлористоводородной![]()
![]()
Калия хлорид получают из природных минералов методом флотации.
Флотация - способ разделения твердых частиц, основанный на их различной смачиваемости и накоплении на поверхности раздела фаз. Процесс проводят в присутствии специальных флотационных реагентов при барботировании пузырьков воздуха через емкость, в которой осуществляется процесс. Очистку раствора калия хлорида проводят также, как при получении натрия хлорида.
Бромиды и иодиды натрия и калия получают однотипно:
- железные стружки обрабатывают бромом (иодом)
![]()
и получают смесь бромида (иодида) железа (II) и бромида (иодида) железа (III): FeBr2 • 2FeBr3 или FeI2 • 2FeI3.
Затем к нагретому до кипения раствору бромида или иодида железа добавляют раствор натрия карбоната до щелочной реакции
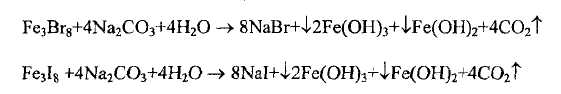
Выпавшие осадки гидроксидов железа отделяют фильтрованием, фильтраты подкисляют соответственно кислотой бромистоводородной или иодистоводородной и сгущают раствор до кристаллизации.
Образующиеся натрия бромид и иодид отфильтровывают и высушивают до образования безводной соли.
Если необходимо получить калия бромид и калия иодид, на второй стадии получения используют калия карбонат.
Натрия фторид получают путем сплавления флюорита с песком и натрия карбонатом
![]()
Из полученной смеси натрия фторид вымывают водой, затем сгущают раствор до начала кристаллизации.
Описание лекарственных веществ приведено в табл. 2.
Подлинность. Все соли водорастворимы, в воде они диссоциируют на составляющие их ионы, которые доказывают при испытании на подлинность.
На катион натрия, согласно ФС, выполняют реакции:
- с цинкуранилацетатом, которая основана на осаждении желтого осадка соли, в состав которой входят три катиона и ацетат-ион — натрийцинкуранилацетата
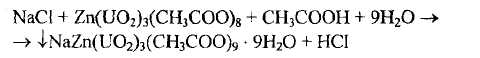
- по окрашиванию бесцветного пламени горелки. Соли натрия окрашивают его в желтый цвет.
- нефармакопейной реакцией на катион натрия является реакция, основанная на образовании осадка с пикриновой кислотой. Ее можно выполнять как классическим способом (в пробирке), так и в микрокристаллоскопическом варианте - в поле зрения видны пучки игольчатых кристаллов
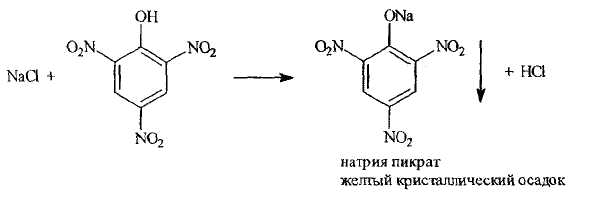
Реакция нашла широкое применение в практике внутриаптечного контроля.
На катион калия, согласно ФС, выполняют реакции:
- с кислотой винной, которая основана на осаждении белого кристаллического осадка гидротартрата калия, растворимого в минеральных кислотах и щелочах, нерастворимого в кислоте уксусной. При выполнении реакции следует соблюдать определенные условия: осаждение вести в присутствии натрия ацетата для связывания образующихся минеральных кислот; для понижения растворимости осадка добавляют спирт; рекомендуется вести реакцию при охлаждении раствора, а для начала кристаллизации потирать стеклянной палочкой стенки пробирки, в которой находится испытуемый раствор и добавленные реактивы
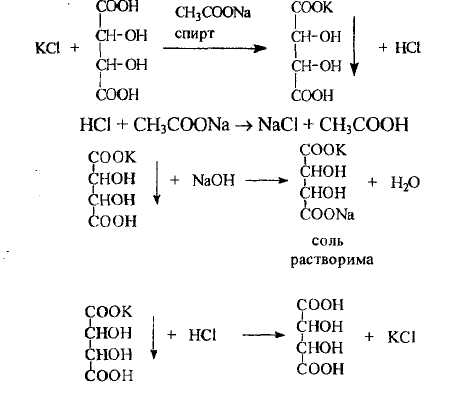
- с гексанитрокобальтатом (III) натрия, которая основана на осаждении двойной комплексной соли - кристаллического осадка желтого цвета
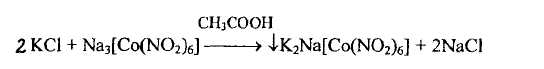
- соли калия окрашивают бесцветное пламя в фиолетовый цвет
Для доказательства анионов используют реакции, основанные на осаждении труднорастворимых галогенидов серебра (кроме фторид-иона) и окислении галогенидов до свободных галогенов (кроме хлорид- и фторид-ионов).
- реакцию осаждения галогенидов серебра нитратом можно представить схемой
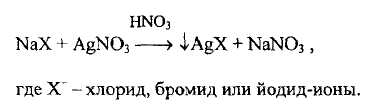
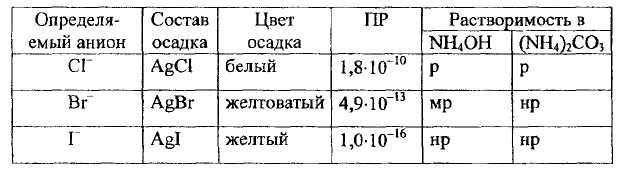
Некоторые свойства осадков галогенидов серебра представлены в таблице 3.
Таблица - 3. Физические и физико-химические свойства галогенидов серебра.
- реакции окисления—восстановления:
Хлориды окисляются только в достаточно концентрированных растворах в кислой среде.
Бромиды являются более сильными восстановителями и могут окисляться хлором, водорода пероксидом, калия перманганатом, калия броматом. В качестве окислителя при определении подлинности бромид-ионов ГФ XI рекомендует использовать хлорамин в кислой среде
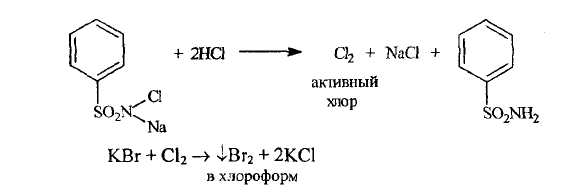
Образующийся бром окрашивает хлороформный слой в желто-бурый цвет.
Иодиды - более сильные восстановители, они окисляются до свободного йода не только сильными окислителями, перечисленными ранее, но и слабыми. Согласно ГФ XI, для этой цели рекомендуются железа (III) хлорид и натрия нитрит, которые не окисляют другие галогениды, т.е. в данном случае эти реактивы являются специфическими для иодидов
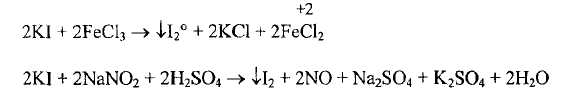
Образующийся иод придает анализируемому раствору темно-бурую окраску, а если извлечь его в хлороформ, то слой хлороформа окрашивается в фиолетовый цвет.
Для доказательства иодидов в субстанции ГФ XI рекомендует реакцию с кислотой серной концентрированной при нагревании.
Эффект реакции - выделение фиолетовых паров иода. Реакция основана на окислении иодидов кислотой серной концентрированной до свободного йода.
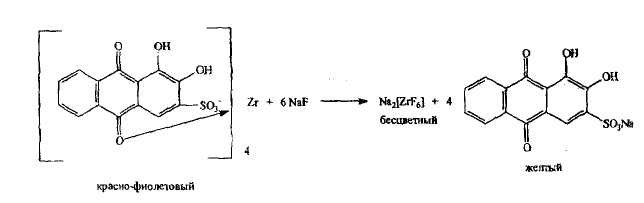
Фторид-ион доказывают преимущественно косвенно; реакции основаны на разрушении исходных комплексных соединений и образовании с фторид-ионом новых более устойчивых комплексов, например: цирконий-ализариновый комплекс, окрашенный в красно-фиолетовый цвет при добавлении раствора, содержащего фторид-ион, разрушается с образованием бесцветного гексафтороциркониата (IV) натрия; при этом освобождается свободный ализарин, имеющий желтую окраску.
или железа роданид, окрашенный в темно-красный цвет, при добавлении натрия фторида обесцвечивается вследствие образования нового комплекса гексафтороферрата (III) натрия
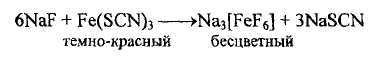
Для доказательства фторид-иона используется также реакция осаждения труднорастворимого кальция фторида

Последовательное доказательство галогенидов в лекарственных формах.
В случае совместного присутствия галогенидов в лекарственных формах для их доказательства используют прием последовательного окисления сильным окислителем - калия перманганатом в кислой среде.
Сначала окисляются более сильные восстановители - иодиды, реакция сопровождается образованием свободного иода, придающего анализируемому раствору темно-бурую окраску; если добавить хлороформ, его слой окрашивается в фиолетовый цвет
![]()
При дальнейшем добавлении окислителя образовавшийся на первой стадии иод окисляется до иодата (иодноватой кислоты), при этом водный и хлороформный слои обесцвечиваются
![]()
После
того, как иодиды будут окислены до
иодатов, дальнейшее добавление окислителя
- калия перманганата приведет к окислению
бромидов
![]()
Раствор при этом окрашивается в желто-бурый цвет; добавляют хлороформ - бром лучше растворяется в хлороформе, чем в воде, взбалтывают анализируемый раствор с хлороформом до полного обесцвечивания (хлороформный слой окрашен в желто-бурый цвет) водного слоя.
После отстаивания слоев водный слой отделяют, избыток калия перманганата удаляют добавлением по каплям раствора пероксида водорода и затем в этом растворе доказывают наличие хлорид-иона реакцией с серебра нитратом.
Испытание на чистоту.
Проводят ряд общих испытаний, характерных для всех лекарственных средств этой группы, и на специфические примеси.
Общие испытания:
на прозрачность и цветность водных растворов — они должны быть бесцветными и прозрачными, что свидетельствует об отсутствии не растворимых в воде или окрашенных соединений (примесей);кислотность и щелочность, т.к. получение лекарственных средств связано с использованием кислот ли щелочей. Кислотность и щелочность растворов оценивается ориентировочно по изменению окраски по определенному индикатору (фенолфталеину или бромтимоловому синему); реакция среды испытуемых растворов должна быть близка к нейтральной;
допустимое содержание общих примесей (сульфаты, железо, тяжелые металлы, мышьяк);
отсутствие солей кальция и бария, использующихся при получении; испытание проводят с кислотой серной разведенной - при этомне должно быть помутнения;
потеря в массе при высушивании, этот показатель различен у лекарственных веществ данной группы - от 0,5% у натрия хлорида до 5%для калия йодида.
Испытание на специфические примеси:
в натрия и калия хлоридах проводят испытание на отсутствие солей магния с натрия гидрофосфатом в присутствии гидроксида аммония - не должно быть помутнения;
в натрия хлориде - на отсутствие солей калия с кислотой винной;
допустимое содержание аммиака с реактивом Несслера;
в калия хлориде - отсутствие солей натрия по окрашиванию пламени (оно не должно окрашиваться в желтый цвет), отсутствие солей аммония по реакции с реактивом Несслера;
в натрия и калия бромидах проводят испытание на иодиды с железа (III) хлоридом в присутствии крахмала - не должно появляться синего окрашивания (иодиды должны отсутствовать); на броматы, для чего к испытуемому раствору добавляют кислоту серную разбавленную - не должно появляться желтого окрашивания, вызванного образованием свободного брома в случае присутствия примеси:
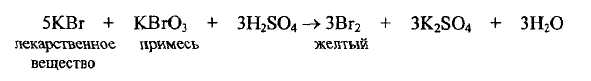
Согласно требованию ФС, желтое окрашивание не должно появляться.
- в натрия и калия иодидах проверяют отсутствие цианидов по реакции образования берлинской лазури (см. «Иод»); иодноватой кислоты (иодатов) при подкислении кислотой серной разведенной в присутствии крахмала не должно появляться синего окрашивания
![]()
отсутствие тиосульфатов и сульфитов для чего к водному раствору добавляют 1 каплю 0,1 моль/л раствора иода - синяя окраска должна сохраняться, т.е. примеси должны отсутствовать; в случае наличия примесей проходят реакции
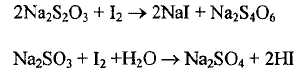
и иод обесцвечивается ;
отсутствие нитратов по реакции восстановления до аммиака цинковой пылью в щелочной среде
![]()
аммиак обнаруживают с красной лакмусовой бумажкой - она не должна синеть, следовательно, аммиак (и нитраты) отсутствуют.
