
- •1. Наглядные пособия:
- •2. Литература:
- •Учебные материалы
- •Распространение в природе
- •Биологическое значение
- •Применение в медицинской практике
- •Раствор иода спиртовой 5%
- •Кислота хлористоводородная
- •Лекарственные вещества - производные гагогенводородиых кислот
- •Получение
- •Методы количественного определения
- •Лабораторная работа Фармацевтический анализ лекарственного вещества VII группы периодической системы д.И. Менделеева
- •Натрия хлорид
- •Раствор йода спиртовой 5%
- •Натрия бромид
- •Натрия иодид
- •Калия хлорид
- •Калия бромид
- •Калия иодид
ГОУ ВПО Омская государственная медицинская академия
Кафедра фармацевтической химии
с курсами аналитической и токсикологической химии
|
|
УТВЕРЖДАЮ Зав. кафедрой фармацевтической химии с курсами аналитической и токсикологической химии, проф., д.х.н. ___________________Е.Г. Атавин
«_____»_______________ 20____г. |
МЕТОДИЧЕСКАЯ РАЗРАБОТКА № 10
для студентов
для проведения лабораторно-практического занятия
на 3 курсефармацевтического факультета
по учебной дисциплине
фармацевтическая химия
на тему: «Общие и специфические методы анализа неорганических препаратов VII группы периодической системы Д.И. Менделеева»
Обсуждена на заседании кафедры
«____»_________________20____г.
Протокол № ______
Омск – 2010 г.
Учебные цели:
закрепить знания по общим и специфическим методам анализа неорганических препаратов VII группы периодической системы Д.И. Менделеева;
знать способы проведения анализа солей галогеноводородных кислот с использованием методов количественного определения;
познакомиться со способами получения галогенидов щелочных металлов;
проводить расчеты по количественному содержанию веществ;
обосновать определение допустимых и недопустимых примесей, заложенные в НД
Воспитательные цели:
развивать интерес студентов к будущей профессии с помощью имитационных методов обучения студентов, связанных с моделированием профессиональной деятельности
повышать творческую активность студентов
В результате изучения темы студенты должны
знать:
основные понятия, характеризующие неорганические препараты VII группы периодической системы Д.И. Менделеева: натрия и калия хлориды, бромиды и иодиды;
способы проведения фармацевтического анализа данных препаратов;
условия хранения препаратов, основанные на физических свойствах препаратов
требования ФС к исследуемым лекарственным средствам
уметь:
анализировать галиды с использованием общих и специфических методов анализа;
проводить количественное определение лекарственных препаратов;
проводить расчеты
получить навыки:
количественного определения препаратов галидов несколькими методами (аргентометрия, меркуриметрия, ионообменная хроматография)
Учебно-материальное обеспечение:
1. Наглядные пособия:
а) расчетные формулы для проведения количественного определения ЛВ;
б) стенд по правилам работы в химической лаборатории
2. Литература:
ФС на натрия и калия хлориды, бромиды, иодиды.
Руководство к лабораторным занятиям по фармацевтической химии: Учеб. пособие / М-во здравоохранения РФ; Ред. А.П. Арзамасцев. - 2001.
Беликов В.Г. Лабораторные работы по фармацевтической химии. - Пятигорск, 2003. - 341с.
Фармацевтическая химия: учеб. пособие для студентов мед.вузов / Ред. А.П. Арзамасцев.
Беликов В.Г. Фармацевтическая химия: учеб. для фармац. вузов и фак./ В.Г. Беликов; УМО по мед. и фармац. образованию вузов России. – 2003.
Лекции по аналитической и фармацевтической химии.
Учебные материалы
Общие и специфические методы анализа неорганических препаратов VII группы периодической системы Д.И. Менделеева
Галогены - фтор, хлор, бром, йод находятся в главной подгруппе VII группы Периодической системы элементов. На внешнем электронном уровне имеют 7 электронов, легко присоединяют еще один электрон до устойчивого октета и образуют отрицательно заряженные анионы, т.е. проявляют окислительные свойства. Окислительные свойства убывают в ряду: F > Cl > Br > I.
В свою очередь, галогенид-ионы проявляют восстановительные свойства, которые убывают в ряду:
I- > Br- > Cl- > F-
В соединениях галогениды имеют также степени окисления +1, +3, +5, +7 (высшая степень окисления).
Распространение в природе
Поскольку галогены достаточно реакционноспособны, в свободном состоянии в природе они не встречаются, находятся в виде соединений со щелочными и щелочноземельными металлами:
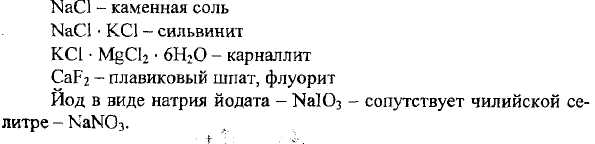
Галогениды содержатся также в морской воде, буровых водах нефтяных скважин, иод в виде органических соединений - в морских водорослях.
Биологическое значение
Галогениды щелочных металлов регулируют водно-солевой баланс; фтор входит в состав костной ткани и эмали зубов, йод входит в состав гормонов щитовидной железы.
Применение в медицинской практике
В зависимости от биологического действия соединения галогенидов можно разделить на следующие группы:
свободные галогены: только йод- обладает антисептическим действием;
галогенводородные кислоты - кислота хлористоводородная - применяется при недостаточной кислотности желудочного сока;
галогениды щелочных металлов (соли галогенводородных кислот):
натрия и калия хлориды регулируют водно-солевой баланс, калия хлорид оказывает также антиаритмическое действие;
натрия и калия бромиды оказывают седативное (успокаивающее) действие;
натрия и калия иодиды применяют при гиперфункции щитовидной железы, как противовоспалительные при бронхиальной астме, заболеваниях глаз, воспалительных заболеваниях дыхательных путей;
натрия фторид назначают при остеопорозе, для профилактики кариеса.
Источники получения:
буровые воды нефтяных скважин;
морские водоросли;
йодаты, сопутствующие месторождениям чилийской селитры.
Получение иода из буровых вод предложено в 20-ых годах прошлого столетия во ВБИХФИ проф. О.Ю. Магидсоном. Содержание соединений иода в буровых водах невелико (около 0,01%), но их запасы велики. При промышленном получении одной из основных стадий является адсорбция на активированном угле.
Процесс получения иода из буровых вод состоит из следующих стадий:
- окисление иодидов натрия нитритом в кислой среде
![]()
- адсорбция иода на активированном угле
![]()
- извлечение йода с адсорбента раствором натрия сульфита
![]()
при этом концентрация йодидов в 200-300 раз превышает первоначальную.
окисление иодидов хлором
![]()
иод отфильтровывают и очищают сублимацией.
Процесс получения иода из морских водорослей включает их сжигают, иодиды извлекают водой и окисляют оксидом марганца (IV) в кислой среде
![]()
иод отфильтровывают и очищают сублимацией.
Описание. Серовато-черные с металлическим блеском пластинки или кристаллы, с характерным запахом, летуч при обычной температуре, при нагревании возгоняется, образуя фиолетовые пары. Очень мало растворим в воде (1:5000), легко растворим в водных растворах йодидов, образуя комплексные соединения бурого цвета.
![]()
Растворим в спирте, эфире (растворы бурого цвета), хлороформе (фиолетового цвета).
Подлинность. Фармакопейной реакцией доказательства иода служит реакция с раствором крахмала, основанная на образовании соединения включения синего цвета. При кипячении окраска исчезает, при охлаждении образуется вновь.
Испытание на чистоту:
прозрачность и цветность растворов иода в 10% растворе натрия тиосульфата, что характеризует отсутствие механических примесей (например, частиц активированного угля)
- отсутствие иодистого циана (ICN — недопустимая примесь), который может образоваться при неполном сгорании водорослей. Обнаружение основано на образовании берлинской лазури в водной вытяжке из лекарственного вещества, куда переходит примесь, если она содержится в нем. При этом последовательно проходят следующие реакции: водную вытяжку (она имеет светло-желтый цвет) обесцвечивают раствором сернистой кислоты
![]()
Затем последовательно добавляют щелочь, железа (II) сульфат, железа (III) хлорид и подкисляют НС1 разведенной; не должно быть синего окрашивания
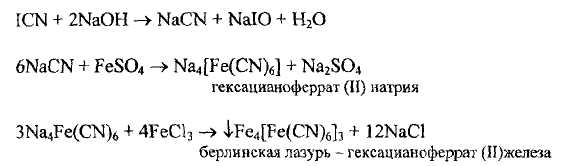
предельное содержание галогенов - такой галогенсодержащей примесью может быть иодмонохлорид (IC1), которая может образоваться при получении йода из буровых вод (см. последнюю стадию процесса). Обнаружение основано на последовательно протекающих реакциях:
1. к обесцвеченной водной вытяжке (см. предыдущее испытание) добавляют концентрированный раствор аммиака, при этом образуются галогениды
![]()
2. к полученному раствору добавляют раствор серебра нитрата и сильно взбалтывают
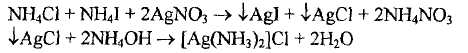
серебра хлорид растворим в аммиаке с образованием комплекса; серебра иодид в аммиаке нерастворим;
3. раствор фильтруют, к фильтрату добавляют кислоту азотную до кислой реакции; он должен выдерживать испытание на хлориды. В растворе появляется опалесценция, его сравнивают с эталонным раствором на хлорид-ион.
![]()
Количественное определение
Тиосульфатометрия. Метод основан окислительно-восстановительных свойствах иода (на восстановлении иода натрия тиосульфатом до иодида, т.е. иод проявляет окислительные свойства), прямое титрование, индикатор крахмал (титруют от синей окраски до обесцвечивания). Поскольку иод очень мало растворим в воде, его навеску растворяют в растворе калия иодида.
Химизм
![]()
Хранение по списку Б в склянках темного стекла с притертыми пробками, в прохладном, защищенном от света месте. Подобные требования к хранению обусловлены летучестью йода, его реакционо-способсностью.
Применение:
наружно в виде 5% спиртового раствора как антисептическое, раздражающее и отвлекающее средство;
йод входит в состав лекарственных препаратов: иодокат (комплекс йода и калия йодида, содержит около 4,5% йода) и иодопирон (комплекс йода с калия йодидом и поливинилпирролидоном, содержит 6-8% иода), применяют как бактерицидные средства.
внутрь в виде 5% раствора назначают для профилактики атеросклероза, гипотиреоза.
