
- •Тема лекції: «акумулятори. Електроліз».
- •Акумулятори.
- •2. Кислотні акумулятори.
- •4,1. Електроліз розплавів
- •4. 2. Електроліз водних розчинів
- •Приклади
- •4.3. Закони електролізу (закони Фарадея)
- •4.4. Застосування електролізу
- •4,4.1. Добування металів та інших речовин
- •4.4.2. Очистка (рафінування) металів
- •4.4.3. Гальванотехніка
- •4.4.3.1. Гальваностегія
- •4.4.3.2. Гальванопластика
Приклади
1) Електроліз водного розчину нітрату калію з вугільними (інертними) електродами:
Дисоціація:
![]() ;
;
Процеси на електродах:

Сумарне іонне рівняння:
![]()
Молекулярне рівняння:
![]()
2) Електроліз розчину калій гідроксиду:
Дисоціація:
![]() ;
;
Процеси на електродах:
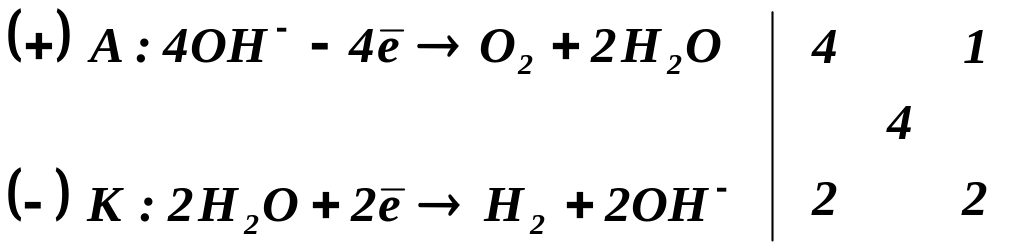
Сумарне рівняння:
![]()
3) Електроліз водного розчину сульфату нікелю з активним нікелевим анодом:
Дисоціація:
![]() ;
;
Aнод
–
;
;
Aнод
–
Процеси на електродах:
![]()
![]() .
.
4.3. Закони електролізу (закони Фарадея)
Англійський вчений Фарадей вивчав зв’язок між кількістю електрики і кількістю речовин, яка зазнала перетворення при електролізі. Він встановив, що для перетворення 1 моль еквівалентів будь-якої речовини, треба затратити однакову кількість електрики. Це число називається сталою Фарадея.
Стала Фарадея рівна добутку сталої Авогадро на заряд електрона:
![]()
Для інших розмірностей:
![]() .
.
І закон Фарадея: маси речовин, що перетворюються на електродах під час електролізу пропорційні кількості електрики, яка пройшла через електроліт.
![]()
![]() –
кількість
електрики, Кл (А∙с);
–
кількість
електрики, Кл (А∙с);
![]() – електрохімічний
еквівалент речовини.
– електрохімічний
еквівалент речовини.
Кількість
електрики
– добуток сили струму (![]() )
на час його проходження через електроліт
(
)
на час його проходження через електроліт
(![]() ):
):
![]() .
.
Електрохімічний
еквівалент речовини
означає масу речовини, що перетворюється
при проходженні через електроліт 1
Кл електрики:
![]() .
Врахувавши значення
і
одержимо:
.
Врахувавши значення
і
одержимо:
![]() ,
,
а для визначення об’єму:
![]() ,
,
де
![]() і
і
![]() - відповідно еквівалентна маса чи
еквівалентний об’єм визначеної речовини.
- відповідно еквівалентна маса чи
еквівалентний об’єм визначеної речовини.
![]() ,
,
![]() .
.
ІІ закон Фарадея: однакові кількості електрики виділяють при електролізі еквівалентні кількості будь-яких речовин, тому маси речовин, що перетворюються на електродах при проходженні однакової кількості електрики, пропорційні їх еквівалентним масам, а об’єми (за н.у.) – еквівалентним об’ємам:
 ,
,
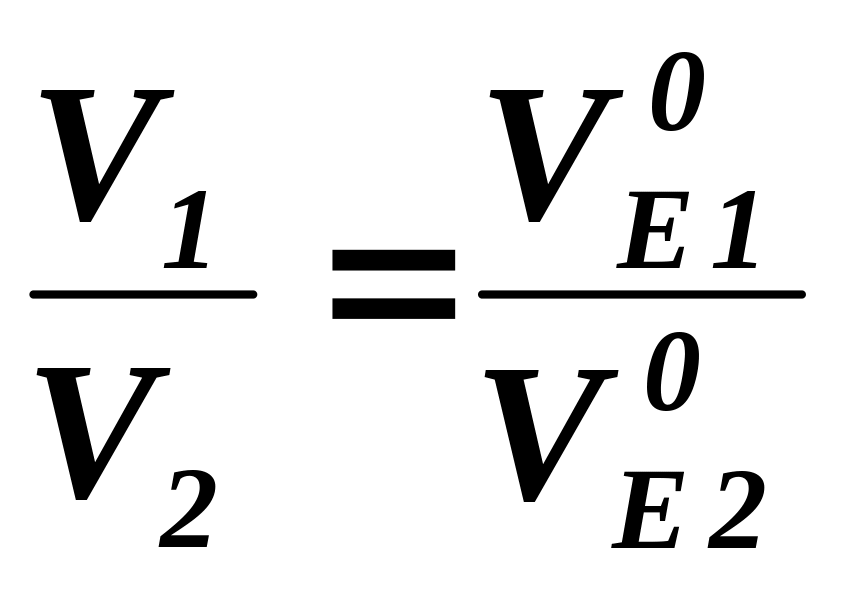 .
.
Вихід за струмом (![]() )
– це відношення фактично одержаної при
електролізі маси речовини (
)
– це відношення фактично одержаної при
електролізі маси речовини (![]() )
до теоретично обчисленої (
)
до теоретично обчисленої (![]() ):
):
![]() .
.
Маса речовини, що виділяється при електролізі фактично завжди менша від теоретично обрахованої за законами Фарадея, а завжди менше 100%. Це пов’язано з втратами струму, а також з вторинними процесами, які відбуваються при електролізі.
4.4. Застосування електролізу
Електроліз широко використовується у хімічній, металургійній промисловості та у гальванотехніці.
Електролітичним методом одержують
метали, водень і кисень з води, хлор і
луг з розчину
![]() ,
фтор з розплаву суміші
,
фтор з розплаву суміші
![]() i
i
![]() ,
окисники: гідроген пероксид, калій
перманганат, хлорати, хромати, гіпохлорити,
деякі органічні речовини, наприклад,
анілін з нітробензолу.
,
окисники: гідроген пероксид, калій
перманганат, хлорати, хромати, гіпохлорити,
деякі органічні речовини, наприклад,
анілін з нітробензолу.
4,4.1. Добування металів та інших речовин
Електролізом
водних розчинів на інертних електродах
одержують мідь, цинк, кадмій, нікель,
кобальт, марганець та інші метали.
Електролітичне
виділення металу з розчину називається
електроекстракцією. Наприклад, електроліз
водного розчину
![]() :
:
А:
![]()
К:
![]() .
.
Електролізом
розплавів добувають метали, що мають
великі від’ємні потенціали (![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() ).
Вони реагують з водою, тому не можуть
бути одержані в розчинах.
).
Вони реагують з водою, тому не можуть
бути одержані в розчинах.
