
- •Кинематика материальной точки. Системы отсчета. Траектория, перемещение, путь, скорость, ускорение. Равномерное и равнопеременное прямолинейные движения.
- •Криволинейное движение. Нормальное и тангенциальное ускорения.
- •Траектория, путь, перемещение, линейная скорость, линейное ускорение.
- •Частные случаи движения
- •Движение точки по окружности. Угловые перемещение, скорость, ускорение. Связь между линейными и угловыми характеристиками.
- •Угол поворота, угловая скорость, угловое ускорение.
- •Связь между линейными и угловыми характеристиками
- •Динамика материальной точки. Инерциальные системы отсчета и первый закон Ньютона
- •Первый закон Ньютона (закон инерции)
- •Фундаментальные взаимодействия. Силы различной природы (упругие, гравитационные, трения), второй закон Ньютона. Масса. Третий закон Ньютона.
- •Динамические характеристики поступательного движения
- •Импульс ( ) векторная величина, равная произведению массы тела на его скорость, характеризует способность механического движения передаваться от одного тела к другому.
- •Импульс силы ( ) векторная величина, численно равная произведению силы на время ее действия и совпадающая по направлению с направлением силы. Второй закон Ньютона
- • Главный вектор системы или равнодействующая (результирующая) сила; n количество сил. Третий закон Ньютона
- •Импульс системы материальных точек, уравнение движения центра масс. Закон сохранения импульса. Закон сохранения импульса для механической системы
- •3. Моментом импульса материальной точки относительно точки о называется векторное произведение радиуса-вектора материальной точки на ее импульс
- •Уравнение моментов
- •Закон сохранения момента импульса
- •Работа при вращательном движении
- •Мощность при поступательном и вращательном движении
- •Кинетическая энергия
- •Потенциальная энергия
- •Потенциальная энергия в поле сил тяжести
- •Потенциальная энергия в поле упругих сил
- •Закон сохранения механической энергии
- •9. Соударение тел. Упругое и неупругое взаимодействия
- •Абсолютно упругий центральный удар двух тел
- •Кинематические и динамические характеристики свободных незатухающих колебаний
- •Вынужденные колебания. Резонанс
- •14. Волновое движение. Уравнение плоской незатухающей бегущей волны. Энергия упругой волны. Вектор плотности потока энергии
- •Уравнение плоской бегущей волны
- •Фазовая скорость
- •Энергия упругой волны. Вектор Умова
- •Термодинамическая система. Параметры состояния термодинамической системы. Основные положения молекулярно - кинетической теории газов
- •Статистическим (молекулярно-кинетическим);
- •Термодинамическим.
- •Суммарный собственный объем частиц намного меньше размеров сосуда, в котором они находятся;
- •Частицы взаимодействуют друг с другом только во время столкновений;
- •Параметры состояния идеального газа
- •Удельный объем (плотность)
- •Молекулярно-кинетическая теория газов
- •16. Основное уравнение молекулярно-кинетической теории газов (уравнение Клаузиуса). Уравнение состояния идеального газа (Менделеева - Клапейрона) Уравнение Клаузиуса
- •Уравнение Менделеева - Клапейрона
- •Внутренняя энергия системы u равна сумме всех видов энергий движения и взаимодействия частиц, составляющих данную систему.
- •Закон равномерного распределения энергии по степеням свободы молекул
- •Работа и теплота. Теплоемкость, ее виды
- •Виды теплоемкости
- •Первый закон термодинамики
- •Определение теплоемкостей Ср , сv
- •18. Основные термодинамические процессы идеального газа. Политропный процесс, его частные случаи: изобарный, изотермический, адиабатный, изохорный
- •Теплота в политропном процессе
- •Работа в политропном процессе
- •Частные случаи политропного процесса
- •19. Второй закон термодинамики. Энтропия. Тепловые двигатели и холодильные машины. Цикл Карно
- •Прямой цикл
- •Обратный цикл
- •Коэффициент полезного действия тепловой машины, работающей по циклу Карно, не зависит от рода рабочего тела, а зависит только от температур нагревателя и холодильника.
- •Энтропия, второй закон термодинамики
Виды теплоемкости
Полная теплоемкость Спол численно равна количеству тепла, которое необходимо сообщить системе, чтобы повысить ее температуру на один градус
![]() (7)
(7)
![]()
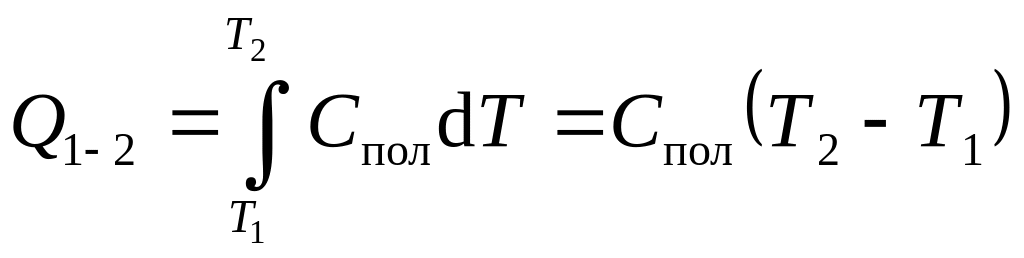 . (8)
. (8)
Молярная теплоемкость С численно равна количеству тепла, которую нужно сообщить одному киломолю вещества, чтобы повысить его температуру на один градус:
![]() (9)
(9)
![]() (10)
(10)
 В
зависимости от характера процесса
различают теплоемкости при постоянном
объеме СV и при постоянном
давлении Ср.
В
зависимости от характера процесса
различают теплоемкости при постоянном
объеме СV и при постоянном
давлении Ср.
![]() - уравнение
Майера
- уравнение
Майера
Первый закон термодинамики
Подобно тому, как в основе механики лежат законы Ньютона и все задачи могут быть решены с их помощью, так в основе термодинамики лежат два закона – два начала термодинамики.
Первое начало термодинамики утверждает тот факт, что в любых процессах должен соблюдаться закон сохранения и превращения энергии, т.е. первое начало представляет собой формулировку закона сохранения и превращения энергии применительно к тепловым процессам.
Второе начало уточняет первое и показывает направление протекания всех процессов – стремление любой системы к минимуму потенциальной энергии.
Рис. 6
![]() (11)
(11)
Тепло, подведенное к термодинамической системе, затрачивается на изменение ее внутренней энергии и на совершение системой работы над окружающими телами.
![]()
![]() , (12)
, (12)
в тепловых двигателях невозможно совершить работу, превышающую получаемую энергию, т.е. вечный двигатель 1-го рода невозможен.
Определение теплоемкостей Ср , сv
1. Изохорный процесс (V = const)
![]()
![]() ,
,
![]()
![]()
![]()
![]()
![]() (13)
(13)
2. Изобарный процесс (р = const)
![]()
![]()
![]()
![]() дифференцируем:
дифференцируем:
![]()
![]() уравнение Майера
(14)
уравнение Майера
(14)
![]() .
(15)
.
(15)
18. Основные термодинамические процессы идеального газа. Политропный процесс, его частные случаи: изобарный, изотермический, адиабатный, изохорный

Термодинамическим процессом называется совокупность последовательных состояний термодинамической системы, сопровождающаяся изменением всех или части параметров состояния.
Равновесным называется такой процесс, который протекает бесконечно медленно при отсутствии разности давлений и температур между термодинамической системой и окружающей средой.
Обратимым называется равновесный процесс, протекающий в прямом и обратном направлениях через ряд одинаковых состояний и возвращающий термодинамическую систему и окружающую среду в исходное состояние.
![]() .
.
Условия полной обратимости:
механическое равновесие;
тепловое равновесие;
отсутствие диссипации (трения).
Политропным называется равновесный обратимый процесс, удовлетворяющий условиям:
рабочее тело – идеальный газ;
я часть подводимой теплоты расходуется на изменение внутренней энергии (
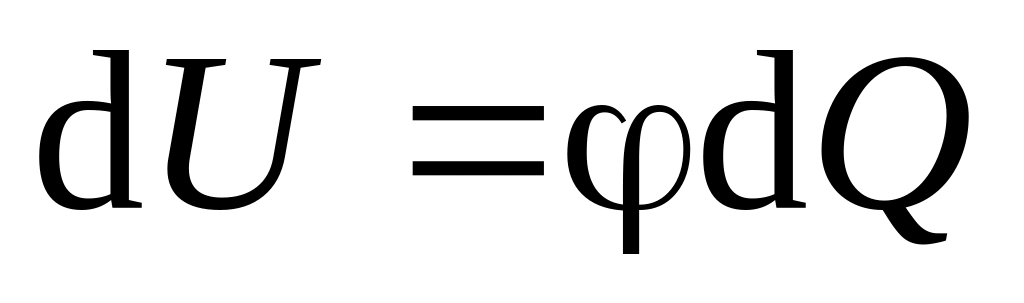 ),
оставшаяся часть теплоты расходуется
на совершение работы (
),
оставшаяся часть теплоты расходуется
на совершение работы ( );
);теплоемкость политропного процесса
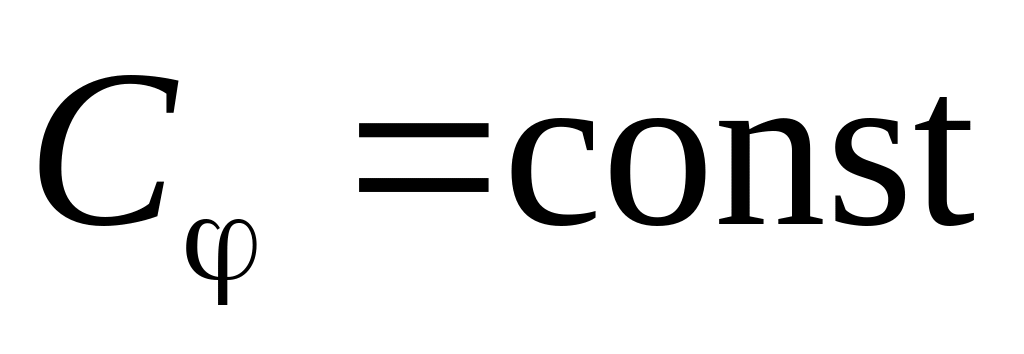 ;
;
![]() . (1)
. (1)
![]() дифференцируем:
дифференцируем:
![]()
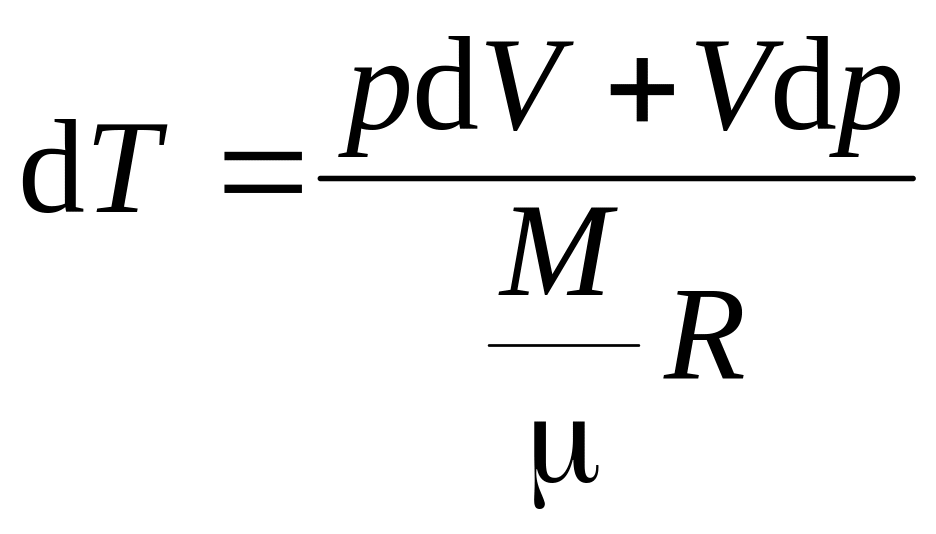
(16)

![]()
![]()
![]() , (2)
, (2)
![]() показатель
политропы (3)
показатель
политропы (3)
![]()
![]()

![]()
![]() уравнение
политропы. (4)
уравнение
политропы. (4)
![]()
![]()
![]() ,
,
![]() показатель адиабаты
. (5)
показатель адиабаты
. (5)
