
Тема:
Моделирование массообменных процессов
План:
1. Моделирование процесса абсорбции
1.1. Равновесие в системах жидкость–газ
1.2. Материальный баланс и кинетические закономерности абсорбции
2. Моделирование процесса ректификации
2.1. Фазовое равновесие в системе жидкость-пар
2.2. Материальный баланс и кинетические закономерности ректификации
2.3. Рабочие линии процесса ректификации в у–х-диаграмме
. Моделирование процесса абсорбции
Абсорбция – поглощение газов или паров из газовых или паровых смесей жидкими поглотителями, называемыми абсорбентами. Возможность осуществления процесса абсорбции основывается на растворимости газов в жидкостях. Процесс абсорбции является избирательным и обратимым, что дает возможность применять его не только с целью получения растворов газов в жидкостях, но также и для разделения газовых или паровых смесей.
1.1. Равновесие в системах жидкость–газ
В качестве основного закона, характеризующего равновесие в системах газ–жидкость, обычно используется закон растворимости газов в жидкости, сформулированный Генри. Согласно этому закону, при данной температуре мольная доля газа в растворе (растворимость) пропорциональна парциальному давлению газа над раствором:
х = р/Е, (1) или р = Ех, (2)
где р – парциальное давление газа над раствором, Па; х – концентрация газа в растворе, мол. доли; Е – коэффициент пропорциональности (коэффициент Генри), Па.
Значения р и х, удовлетворяющие уравнению (1), имеют место при достижении равновесия между фазами; эти значения следует рассматривать как равновесные; р – парциальное давление газа, равновесное с раствором, имеющим концентрацию х, или х – концентрация газа в растворе, равновесная с газом, в котором парциальное давление распределяемого газа равно р.
Коэффициент Е зависит от природы растворяющегося вещества и температуры:
ln E = –q/(RT) + C, (3)
где q – теплота растворения газа, кДж/кмоль; R = 8,314 кДж/(кмоль·град) – универсальная газовая постоянная; T – температура растворения, К; C – постоянная, зависящая от природы газа и жидкости и определяемая опытным путем.
Рис. 1. Зависимость растворимости газа в жидкости от его парциального давления над раствором при различных температурах
Из равенства (3) и рис. 1. видно, что с ростом температуры растворимость газов в жидкостях уменьшается. При растворении газа в жидкости температура последней обычно повышается вследствие выделения значительного количества тепла.
Количество тепла, выделяющегося при абсорбции, может быть найдено как
Qаб = qдL(х1 – х2), (4)
где qд – дифференциальная теплота растворения в пределах изменения концентраций х1 – х2, кДж/кг; L – количество абсорбента в кг.
Если абсорбция ведется без отвода тепла, то можно допустить, что все выделяющееся тепло идет на нагревание жидкости и температура последней повышается на величину
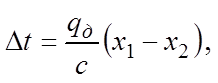
(5)
где с – теплоемкость раствора, кДж/(кг·К).
Парциальное давление растворяемого газа в газовой фазе, соответствующее равновесию, может быть заменено равновесной концентрацией. Согласно закону Дальтона, парциальное давление компонента в газовой смеси равно общему давлению, умноженному на мольную долю этого компонента в смеси, т.е.
р = Р у и у = р/Р,
где Р – общее давление газовой смеси;
у – концентрация распределяемого газа в смеси, мольные доли.
Сопоставляя последнее равенство с (2), найдем
у = р/Р = (Е/Р)х или у = Арх, (6)
где Ар = Е/Р – константа фазового равновесия.
1.2. Материальный баланс и кинетические закономерности абсорбции
Материальный баланс процесса абсорбции выражается общим уравнением
G(Yн – Yк) = L(Xк – Xн),
где G – поток газовой смеси, кмоль/ч инертного газа; L – поток абсорбента, кмоль/ч абсорбента.
Кинетические закономерности абсорбции соответствуют общему уравнению массопередачи для двухфазных систем:
dM = Ky(Y – Yp)dF; dM = Kx(Xp – X)dF.
В этих уравнениях движущую силу Y – Yp часто заменяют на р – рр, а Х – Хр — на Ср – С. Тогда
dM = Kp(р – рр)dF (7)
dM = Kc(Ср – С)dF (8)
где р – рабочее парциальное давление распределяемого газа в газовой смеси, Па; рр – равновесное давление газа над абсорбентом, соответствующее рабочей концентрации в жидкости, Па; С – рабочая концентрация распределяемого газа в жидкости, кмоль/м3; Ср – равновесная концентрация распределяемого газа в жидкости, соответствующая рабочему парциальному давлению его в газовой смеси.
Материальный баланс процесса абсорбции выражается общим уравнением
G(Yн – Yк) = L(Xк – Xн),
где G – поток газовой смеси, кмоль/ч инертного газа; L – поток абсорбента, кмоль/ч абсорбента.
Кинетические закономерности абсорбции соответствуют общему уравнению массопередачи для двухфазных систем:
dM = Ky(Y – Yp)dF; dM = Kx(Xp – X)dF.
В этих уравнениях движущую силу Y – Yp часто заменяют на р – рр, а Х – Хр — на Ср – С. Тогда
dM = Kp(р – рр)dF (7)
dM = Kc(Ср – С)dF (8)
где р – рабочее парциальное давление распределяемого газа в газовой смеси, Па; рр – равновесное давление газа над абсорбентом, соответствующее рабочей концентрации в жидкости, Па; С – рабочая концентрация распределяемого газа в жидкости, кмоль/м3; Ср – равновесная концентрация распределяемого газа в жидкости, соответствующая рабочему парциальному давлению его в газовой смеси.
