
Катаболизм аминокислот
Вы уже знаете о том, что избыток аминокислот не депонируется, а расщепляется т.е. подвергается катаболизму. Это осуществляется в 3х случаях:
Если организм с пищей получает больше аминокислот, чем необходимо для белкового синтеза(гиперпротеиновая диета)
Если много аминокислот освобождается при распаде собственных белков и не все используются на биосинтез белков.
Во время голодания или при сахарном диабете, когда углеводов нет или нарушена их утилизация и в качестве топлива используются белки(в норме примерно 90% энергии от углеводов и липидов)
Во всех этих случаях аминокислоты теряют свои аминогруппы, т.е. подвергаются дезаминированию и превращаются в соответствующие α-кетокислоты.
Для животных тканей преобладающим является окислительный тип расщепления –
Окислительное дезаминирование бывает прямым и непрямым(трансдезаминирование)
Прямое окислительное дезаминирование - происходит в две стадии: на первой стадии - происходит дегидрирование и образование аминокислоты, а на второй – спонтанный гидролиз с образованием аммиака и кетокислоты.
Катализирует процесс – L-оксидаза аминокислоты. Кофермент – ФЛЕН(содержится в почках и печени)
Схема процесса:
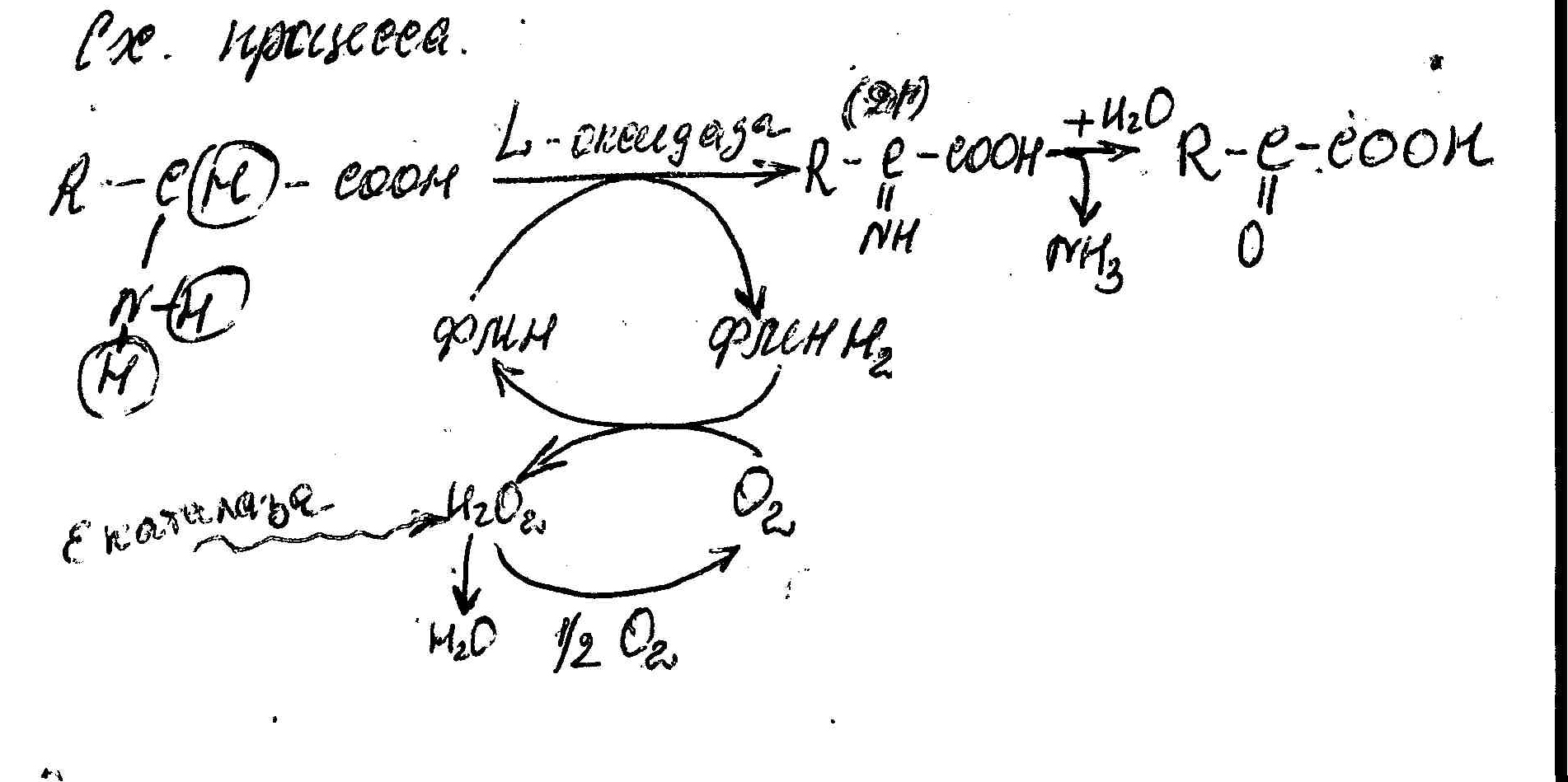

Восстановленный Кофермент окисляется молярным О2 без участия цитохромов с образованием H2O2 и H2O E-каталазой, широко распространённой
Однако прямое окислительное дезаминирование большинства аминокислот процесс малоактивный, т.к. оптимум pH для L-оксидаз примерно равен 10(идеальная среда).
При физиологическом значении pH(примерно 7) высокоактивна ,лишь, Глутамат-ДГ, кофермент НАД или НАДФ. Она обратимо катализирует окислительное дезаминирование глутаминовой кислоты.
(Схема процесса аналогичная, поэтому напишем уравнение без промежуточных соединений)
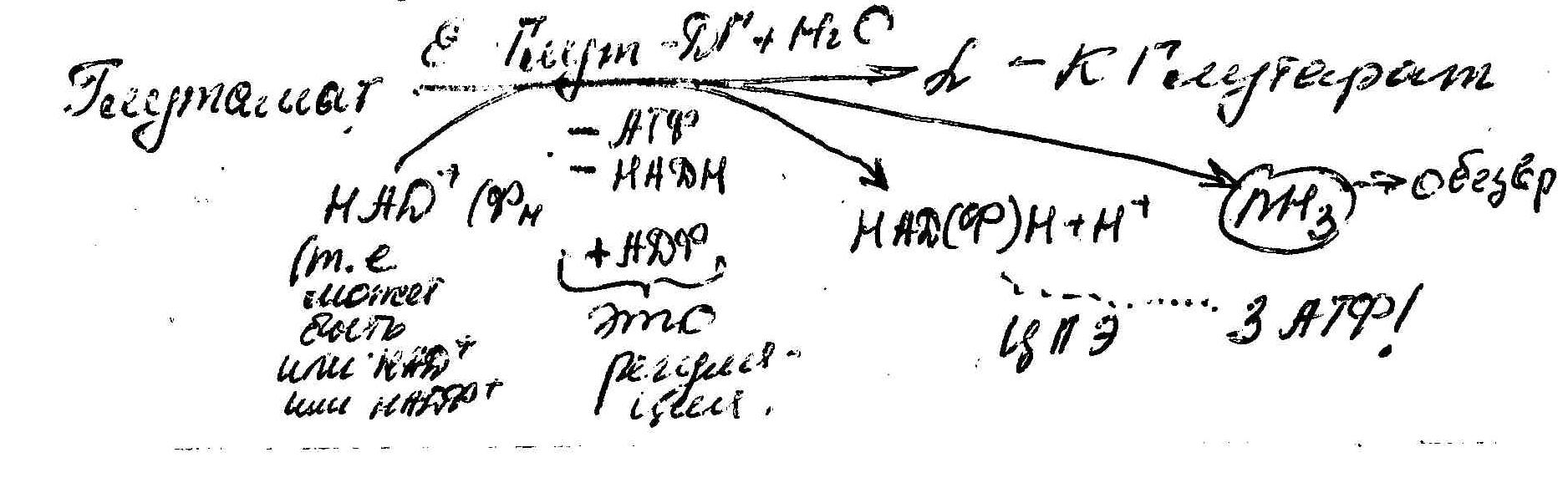
Глутамат ДГ- регуляторный, аллостерический фермент, ингибируется при высоком энергетическом заряде в клетке.
Обратный процесс – восстановительное аминировние α-КГ свободным аммиаком.
Каким же образом аминокислоты подвергаются дезаминированию, если прямой путь для большинства неактивен?
Дезаминирование большинства аминокислот(всех кроме сер,тре,цис,гис) осуществляется путём непрямого окислительного дезаминирования или трансдезаминирования.
Процесс включает две стадии:
Трансамин с участием любой аминокислоты и обязательно α-КГ. Происходит направленный на α-КГ перенос аминогрупп с образованием глутаминовой кислоты. E-TA, Ко-B6
Окислительное дезаминирование глутаминовой кислоты E – Глут ДГ, Ко – НАД(Ф).
Схема трансаминирования
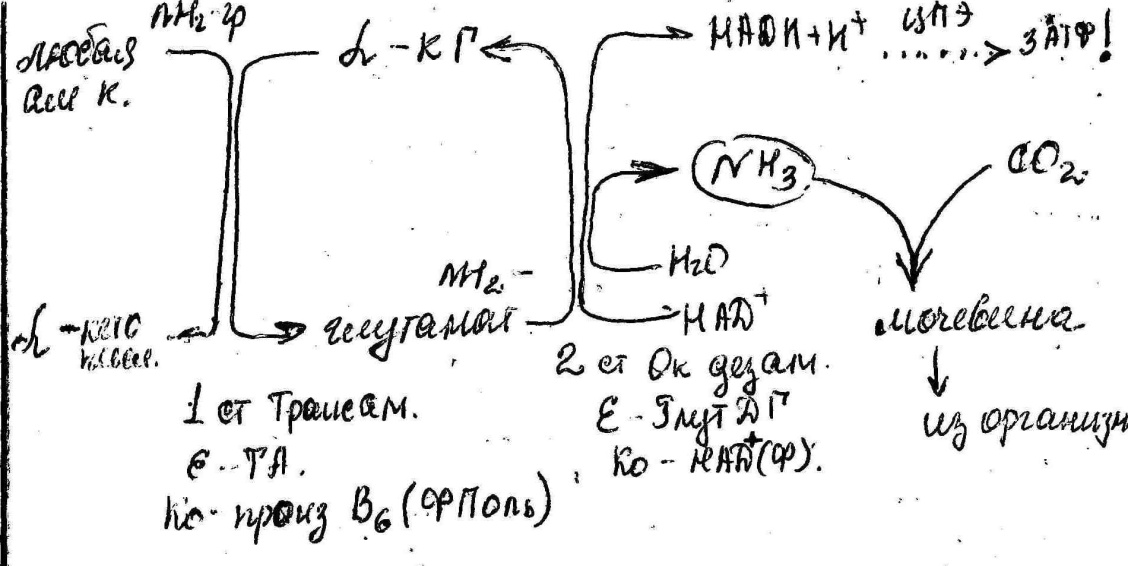
Схема отражает весь(путь) поток азота при катаболизме аминокислот
Декарбоксилиование аминокислот
В животных организмах существуют различные типы декарбоксилирования. Среди них наибольший интерес ( с медицинской точки зрения) представляет α-декарбоксилирование, т.к. продуктами этих реакций являются биогенные амины, которые оказывают сильное фармакологическое воздействие на многие физиологические функции человеческого оганизма. Процесс необратимый, E-декарбоксилазы аминокислот, Ко-производные B6(ФПоль);
Механизм реакции подобен механизму трансаминирования.
Несколько примеров:
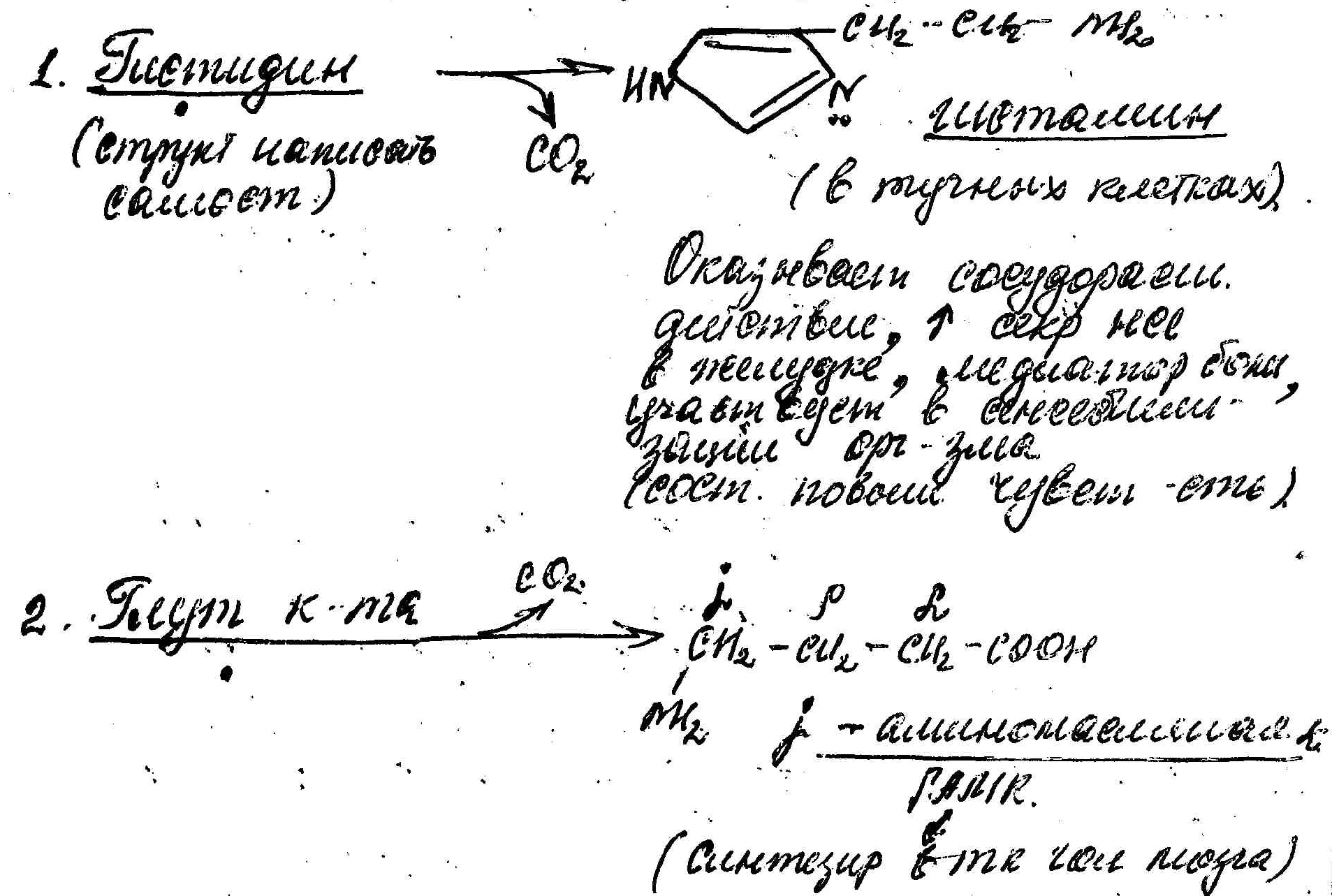
Тормозной медиатор ЦНС. Используется в клинике для лечения заболеваний, связанных с резким возбуждением коры головного мозга(при эпилепсии).
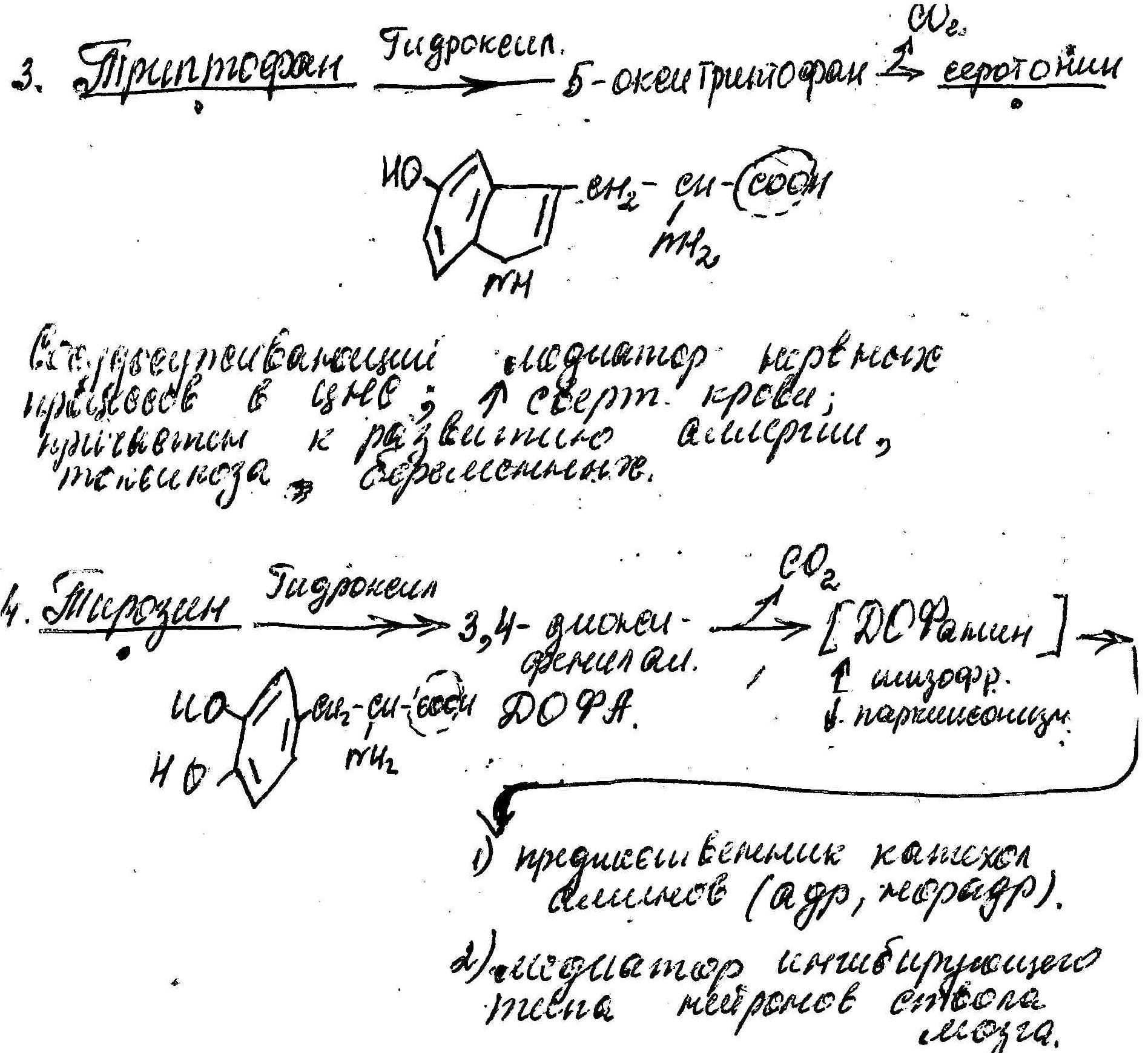
! У больных паркинсонизмом [Дофамина]
до 5% от N
У больных паркинсонизмом [Дофамина]
до 5% от N
! При шизофрении наблюдается избыточное содержание ДОФамина в структурах головного мозга.
Обезвреживание биогенных аминов
Накопление биогенных аминов может быть опасным, т.к. они оказывают мощное воздействие на биологические процессы. В органах и тканях человека существует механизм их обезвреживания.
Это процесс окислительного дезаминирования аминов под действием Е-МАО, моноаминооксидаз ФАД-зав, с образованием альдегидов и аммиака (лок в мышцах).
Схема процесса:
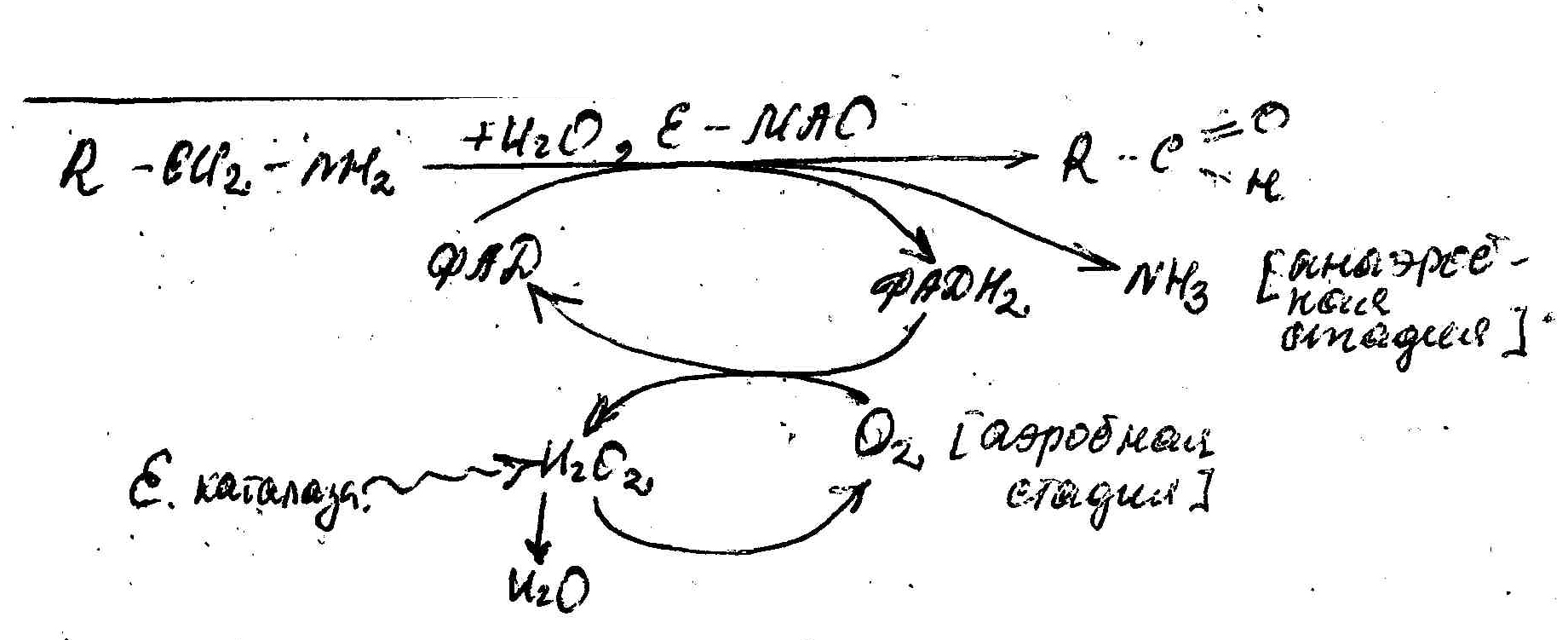
В клинической практике используется некоторые ингибиторы Е-МАО(гармин, паргилин…) при лечении гипертонических болезнях, депрессивных состояний, шизофрении.
