
Коллигативные свойства растворов. Осмос.
Вопросы:
Биологически важные свойства воды: полярность и способность образовывать водородные связи. Примеры водородных связей в биологических системах.
Коллигативные свойства растворов.
Осмос, осмолярность, тоничность. Нормальная осмолярность плазмы крови.
Осмос в биологических системах. Поведение эритроцитов в растворах различной концентрации.
Биологическое значение коллоидно-осмотического(онкотического) давления. Гипотеза Старлинга. Механизм возникновения отёков при гипопротеинемии.
1 - Биологически важные свойства воды: полярность и способность образовывать водородные связи. Примеры водородных связей в биологических системах.
Вода́ (оксид водорода) — прозрачная жидкость, не имеющая цвета (в малом объёме) и запаха. Химическая формула: Н2O.
Вода – универсальный растворитель. В ней растворяются как органические, так и не органические вещества. Процесс зависит от температуры(чем выше температура, тем быстрее идёт растворение) и протекает самопроизволно.
Свойства воды:
Способность воды образовывать водородные связи
Полярность
Данные свойства воды обусловлены строением её молекулы и структурированностью. Молекула H2O содержит две ковалентные связи. Они поляризованы, так как электронная плотность связей сдвинута в сторону электроотрицательного кислорода, имеющего две неподелённые электронные пары. На атомах водорода локализуется частичный положительный заряд. На атоме кислорода – частично отрицательный.
Таким образом молекула воды представляет из себя диполь. Благодаря такому разделению зарядов, вода может соединятся между собой. Молекулы воды могут притягиваться друг к другу засчёт электронных взаимодействий между (σ+ и σ-).
H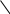
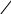 H
H
 O
O
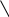
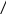 H
H
H
H
O
Такой тип электростатического напряжения называют водородной свзязью.
Водородная связь слабее ковалентной, но обладая свойством многочисленности, водородные связи обеспечивают стабильность воды. Именно водородные связи определяют такие свойства воды, как:
Низкая теплопроводность и высокая теплоёмкость
Высокая температура кипения и низкая температура замерзания
Способность воды быть хорошим растворителем
Примеры водородных связей в биосистемах
Примеры:
Водородные связи возникают между комплиментарными азотистыми основаниями и стабилизируют вторичную структуру нуклеиновых кислот. Так между аденином и тимином возникают две водородные связи, а между гуанином и цитозином три.
Водородные связи стабилизируют вторичную третичную и четвертичную структуру белка.
Водородные связи образуются при растворении в воде многих кристаллических солей и различных органических соединений(альдегиды, спирты, аминокислоты, углеводы). Растворимость этих веществ в воде обусловлена способностью воды образовывать водородные связи с функциональными группами этих соединений.
В воде могут находится в растворённом состоянии вещества, содержащие в своём составе гидрофобные и гидрофильные группы. Например соли ВЖК(мыла).
В структуре ЖК, COOH группа образует полярную, гидрофильную «головку», а жирного ряда углеродный радикал – гидрофобный «хвост». Соль ВЖК легко дисперсирует в воде, образуя агрегаты, называемые мицеллами.
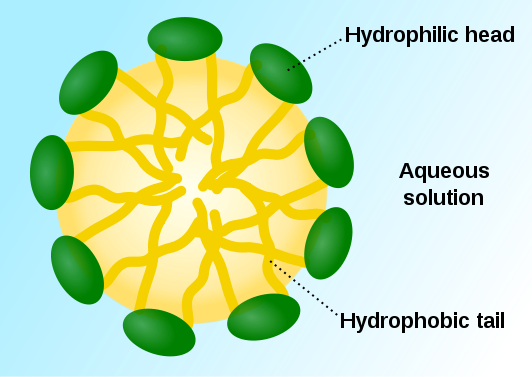
В них гидрофобные хвосты ЖК скрыты от водной среды внутри мицеллы, а полярные головки обращены к воде, образуя с ней водородные связи.
2. Коллигативные свойства растворов
Коллигативные(взаимосвязанные) свойства растворов – это свойства растворов, которые зависят только от числа растворённых молекул в единице объёма раствора и не зависят от их природы.
Один моль любого неионизированного соединения содерит строго определённое число молекул или Авогадрово число.(NA = 6,02×1023 ).
Таким образом, одномоляльные растворы глицина глюкозы и др. должны иметь одинаковую температуру замерзания/кипения и одинаковое осмотическое давления, поскольку оба этих раствора содержат одинаковое число молекул в одном литре воды.
К коллигативным свойствам относят:
Диффузию
Понижение давление насыщенного пара растворителя над раствором по сравнению с давлением пара над чистым растворителем
Повышение температуры кипения раствора
Понижение температуры замерзания раствора
Осмотрическое давление.
Все биологические жидкости обладают коллигативными свойствами, так как в них растворены органические и неорганические вещества.
1 – Диффузия – самопроизвольный процесс выравнивания растворённого вещества в растворе. Она обусловлена тепловыми движениями частиц растворённого вещества и раствора. Диффузия прекращается, если концентрация веществ во всех частях раствора становится одинаковой.
Скорость диффузии зависит от:
Температуры(чем выше Т, тем быстрее протекает диффузия)
От градиента концентрации веществ в растворе( чем выше градиент концентрации, тем быстрее протекает диффузия)
От вязкости раствора(чем меньше вязкость, тем быстрее протекает диффузия)
От размера диффундирующих частиц( чем меньше частица, тем выше скорость)
2- Понижение давления насыщенного пара растворителя над раствором по сравнению с давлением насыщенного пара над чистым раствором


 P-раствора
P-растворителя
P-раствора
P-растворителя
3,4 Осмос. Осмотическое давление
Осмос – явление односторонней диффузии молекул растворителя через полупроницаемую мембрану в стороню раствора с большей концентрацией.
Осмос формируется при наличии осмотического давления.
Осмотическое давление — сила, действующая на полупроницаемую мембрану, разделяющую два раствора с разной концентрацией растворенных веществ и направленная от более концентрированного к более разбавленному раствору.
