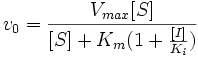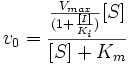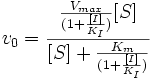Конкурентное ингибирование
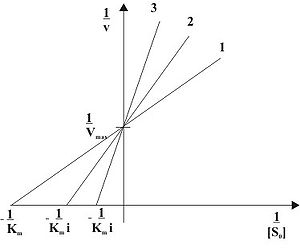
Конкурентное ингибирование при различных концентрациях ингибитора в двойных обратных координатах ( 1 ... [I]=0, 2 ... [I]>0, 3 ... [I]>[I]2)
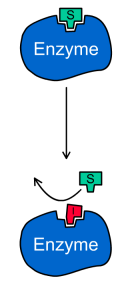
В этом случае ингибитор связывается в активном центрефермента и конкурирует за него с субстратом. Таким образом, конкурентный ингибитор не связывается с фермент-субстратным комплексом (ES на рис.1), то есть константа диссоциации Ki' >> 1.
Конкурентный ингибитор обычно структурно схож с субстратом, однако фермент не способен катализировать реакцию в присутствии ингибитора из-за отсутствия у последнего необходимых функциональных групп.
Схема конкурентного ингибирования и уравнение Михаэлиса-Ментен для него выглядят следующим образом:
|
|
Видно, что при конкурентном ингибировании максимальная скорость реакции Vmax не меняется, а кажущаяся константа Михаэлиса увеличивается в (1 + [I]/Ki) раз. Поэтому в двойных обратных координатах Лайнуивера-Берка(зависимость 1/v0 от 1/[S]) при разных концентрациях ингибитора получают семейство прямых с различным наклоном, пересекающихся в одной точке на оси ординат.
Константу ингибирования Ki обычно определяют так: проводят ряд измерений кажущейся константы Михаэлиса при различных концентрациях ингибитора, затем строят зависимость этой величины от концентрации ингибитора. Тангенс угла наклона полученной прямой равен Km/Ki.
Неконкурентное ингибирование
![]()
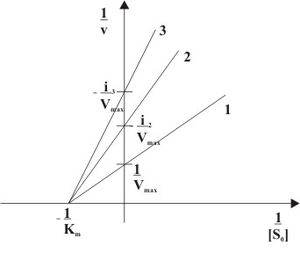
Неконкурентное ингибирование в двойных обратных координатах при различных концентрациях субстрата ( 1 ... [I]=0, 2 ... [I]>0, 3 ... [I]>[I]2)
Неконкурентный ингибитор не мешает связыванию субстрата с ферментом. Он способен присоединяться как к свободному ферменту, так и к фермент-субстратному комплексу с одинаковой эффективностью. Ингибитор вызывает такие конформационные изменения, которые не позволяют ферменту превращать субстрат в продукт, но не влияют на сродство фермента к субстрату.
Схема и уравнение Михаэлиса-Ментен в случае неконкурентного ингибирования:
|
|
При неконкурентном ингибировании константа Михаэлиса не изменяется, а максимальная скорость реакции уменьшается в (1 + [I]/Ki) раз. Поэтому в двойных обратных координатах семейство прямых, отвечающих разным концентрациям ингибитора, пересекается в одной точке на оси абсцисс.
Бесконкурентное ингибирование
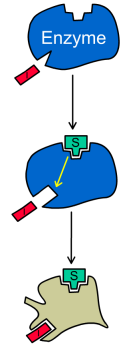
При бесконкурентном ингибировании ингибитор связывается только с фермент-субстратным комплексом, но не со свободным ферментом. Субстрат, связываясь с ферментом, изменяет его конформацию, что делает возможным связывание с ингибитором. Ингибитор, в свою очередь, так меняет конформацию фермента, что катализ становится невозможным.
Схема и уравнение Михаэлиса-Ментен в случае бесконкурентного ингибирования:
|
|
Максимальная скорость реакции и кажущаяся константа Михаэлиса уменьшаются в одинаковое число раз. Поэтому в двойных обратных координатах для разных концентраций субстрата получаем семейство параллельных прямых.
Необратимое ингибирование
Формирование стабильного комплекса ингибитора с ферментом, ведущее к его необратимой инактивации. Случай необратимого ингибирования можно обнаружить по тому признаку, что при разбавлении раствора не происходит повышения
удельной активности фермента, как в случае обратимого ингибирования
В сравнениии конкурентного и неконкурентного важно знать
8
Активация ферментов путем частичного протеолиза. Некоторые ферменты синтезируются первоначально неактивными и лишь после секреции из клетки переходят в активную форму. Неактивный предшественник называется проферментом. Активация профермента включает модификацию первичной структуры с одновременным изменением конформации. Например, трипсиноген, синтезированный в поджелудочной железе, затем в кишечнике превращается в трипсин путем удаления фрагмента с N-конца: энтеропептидаза трипсиногентрипсин + Val-(Acn) -Lys Расщепление определенных пептидных связей «запускает» новые взаимодействия R-групп по всей молекуле, приводя к новой конформации, в которой R-группы активного центра занимают оптимальное положение для катализа. Нарушения структуры какого-либо фермента, ведущие к снижению его активности, приводят к нарушению метаболических путей, в которых участвует этот фермент. Такие нарушения почти всегда проявляются как болезни. Повреждения ферментов бывают двух типов: наследственные дефекты строения фермента и повреждения, вызванные попадающими в организм токсическими веществами, ингибирующими фермент.
9
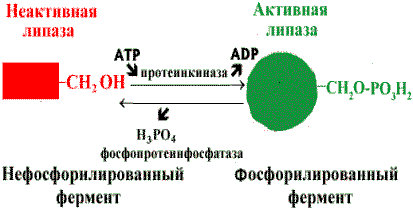
Регуляция активности ферментов путем фосфорилирования-дефосфорилирования . Фермент изменяет активность в результате ковалентной модификации.
Регуляция активности липазы |
В этом случае фосфатная группа - ОРО32- присоединяется к гидроксильным группам в остатках серина, треонина или тирозина. В зависимости от природы фермента фосфорилирование может его активировать или, наоборот, инактивировать. Реакция присоединения фосфатной группы и ее отщепление катализируют специальные ферменты - протеинкиназы и протеинфосфатазы.
10
Регуляция путем ассоциации-диссоциации субъединиц в олигомерном ферменте. Этот процесс иногда начинается с ковалентной или нековалентной модификации одной из субъединиц. Например, фермент протеинкиназа в неактивной форме построена как тетрамер R2C2 (R и С - разные субъединицы). Активная протеинкиназа представляет собой субъединицу С, для освобождения которой необходима диссоциация комплекса. Активация фермента происходит при участии cAMP (циклоаденозинмонофосфорная кислота), которая способна присоединиться к субъединице R, после чего изменяется конформация, комплементарность субъединиц R и С и происходит диссоциация комплекса: R2C2 + 2cАМР 2С + 2(R -сАМР) Циклический АМР является продуктом АТР, превращение которой катализирует фермент аденилатциклаза: АТРс АМР + Н4Р2О7
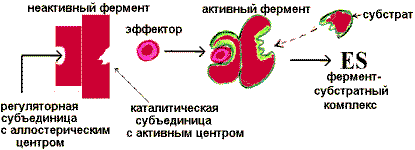
11Аллостерическая регуляция. Фермент изменяет активность с помощью нековалентно связанного с ним эффектора. Связывание происходит в участке, пространственно удаленном от активного (каталитического) центра. Это связывание вызывает конформационные изменения в молекуле белка, приводящие к изменению определенной геометрии каталитического центра. Активность может увеличиться - это активация фермента, или уменьшиться - это ингибирование.
Аллостерическая активация фермента |
«Сообщение» о присоединении аллостерического активатора передается посредством конформационных изменений каталитической субъединице, которая становится комплементарной субстрату, и фермент «включается». При удалении активатора фермент вновь переходит в неактивную форму и «выключается». Аллостерическая регуляция является основным способом регуляции метаболических путей.
12
Коферментная роль витаминов:
окислительное декарбоксилирование
окисление углеводов в пентозном цикле
холинэстеразная реакция