
Коллоквиум по ферментам
Общие и специфические свойства ферментов. Механизм действия ферментов
Понятие активного центра фермента. Этапы ферментативного катализа
Кинетика ферментативности. Влияние T и PH
Классификация ферментов. Примеры
Кинетика ферментативных реакций. Влияние концентрации субстрата на скорость ферментативной реакции. Уравнение Михаэлиса-Ментена. Роль KM и Vmax в характеристике ферментов.
Классификация ингибиторов ферментов. Примеры.
Обратимое ингибирование ферментов. Сравнительная характеристика обратимого и необратимого ингибирования
Регуляция активности ферментов путём частичного протеолиза. Механизм процесса. Примеры
Регуляция активности ферментов путём фосфолирирования и дефосфолирирования . Механизм процесса. Примеры
Регуляция активности ферментов путём ассоциации и диссоциации
Аллостерическая регуляция активности ферментов
Коферментная роль витаминов( B1,B2 ,B3, B6), биотина, липоевой кислоты
Применение ферментов в диагностике. Изоферментный спектр лактатдегидрогеназы(ЛДГ)
Использование соотношения изоферментов в диагностике.
Применение ферментов и их ингибиторов в качестве лечебных препаратов
1 Свойства ферментов
Функции ферментов сводятся к ускорению химических реакций, причем ферменты отличаются от других катализаторов тремя уникальными свойствами:
высокой эффективностью действия;
специфичностью действия;
способностью к регуляции;
Механизм действия ферментов
Акт катализа складывается из трех последовательных этапов.
1. Образование фермент-субстратного комплекса при взаимодействии через активный центр.
2. Связывание субстрата происходит в нескольких точках активного центра, что приводит к изменению структуры субстрата, его деформации за счет изменения энергии связей в молекуле. Это вторая стадия и называется она активацией субстрата. При этом происходит определенная химическая модификация субстрата и превращение его в новый продукт или продукты.
3. В результате такого превращения новое вещество (продукт) утрачивает способность удерживаться в активном центре фермента и фермент-субстратный, вернее уже фермент-продуктный комплекс диссоциирует (распадается).
Виды каталитических реакций:
А+Е = АЕ = БЕ = Е + Б
А+Б +Е = АЕ+Б = АБЕ = АБ + Е
АБ+Е = АБЕ = А+Б+Е, где Е - энзим, А и Б - субстраты, либо продукты реакции.
2
Субстрат связывается с ферментам в определённом месте, которое называется активный центр.
Активный центр — особая часть молекулы фермента, определяющая её специфичность и каталитическую активность.
Активный центр непосредственно осуществляет взаимодействие с молекулой субстрата или с теми её частями, которые непосредственно участвуют в реакции. Характер взаимодействия фермента и субстрата говорит о наличии в активном центре ряда структурных групп, соединяющихся с различными участками субстрата.
Взаимодействие между активным центром фермента и молекулой субстрата осуществляется при их сближении на расстояние порядка 15—20ангстрем, с увеличением расстояния оно быстро ослабевает (хотя среди различных ферментов могут иметь место вариации).
В АЦ различают:
А) участок связывания, где происходит связывание субстрата при помощи трех точек фиксации с неков.связью.
Б) Каталитический участок, где протекают химические превращения.
Основные этапы ферментативного катализа
1 этап. Ориентировочная сорбция субстрата на активном центре фермента с образованием обратимого E-S комплекса (фермент-субстратного). На этом этапе происходит взаимодействие адсорбционного центра фермента с молекулой субстрата. При этом и субстрат подвергается конформационной перестройке. Все это происходит за счет возникновения слабых типов связей между субстратом и адсорбционным центром фермента. В результате этого молекула субстрата подается на каталитический центр в наиболее удобном для него положении. Этот этап является легко обратимым, потому что здесь участвуют только слабые типы связей. Кинетическая характеристика 1-го этапа ферментативного катализа - константа Михаэлиса (Км).
2 этап. Химические превращения молекулы субстрата в составе фермент-субстратного комплекса с образованием комплекса фермента с химически преобразованным субстратом. На этом этапе разрываются одни ковалентные связи и возникают новые. Поэтому этот этап протекает значительно медленнее, чем 1-й и 3-й этапы. Именно скорость второго этапа определяет скорость всей ферментативной реакции в целом. Значит, скорость ферментативного процесса в целом характеризуется величиной k+2, которая является почти всегда самой маленькой из всех частных констант скоростей. Кинетическая характеристика 2-го этапа - максимальная скорость (Vmax).
3 этап. Десорбция готового продукта из его комплекса с ферментом. Этот этап протекает легче, чем 2-й. Он, как и 2-й этап, тоже необратим. Исключение - обратимые ферментативные реакции.
3
Кинетика изучает влияние разных факторов на скорость реакции.
Скорость ферментативной реакции (У) измеряют по убыли субстрата или приросту продукта за единицу времени.
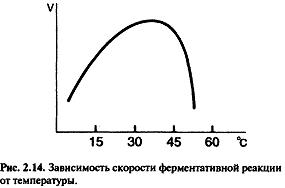 При
повышении температуры на каждые 10 °С
скорость реакции увеличивается примерно
вдвое (правило Вант-Гоффа).
При
повышении температуры на каждые 10 °С
скорость реакции увеличивается примерно
вдвое (правило Вант-Гоффа).
При высоких температурах разрушаются слабые межрадикальные связи, изменяется конформация фермента, т.е. происходит денатурация. Денатурация означает уменьшение количества активного фермента, соответственно снижается и скорость реакции.
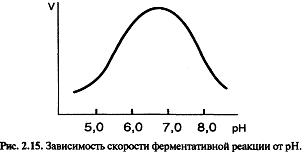 Оптимум
рН для большинства ферментов находится
между 5,0 и 9,0.
Оптимум
рН для большинства ферментов находится
между 5,0 и 9,0.
Колоколобразная форма кривой означает, что существует некоторое оптимальное состояние ионизации фермента и субстрата, обеспечивающее наилучшее со единение фермента с субстратом и катализ реакции.
От рН зависят:
- ионизация аминокислотных остатков, включенных в катализ;
- ионизация субстрата;
- конформация фермента и его активного центра.
4
Ферменты – это биоакатализаторы белковой природы.
Уровни организации ферментов:
Простейшие – мономерные ферменты – 1ППЦ уложенная в виде компактной трёхмерной структуры.
Олигомерные ферменты – две и больше однородных полипептидных цепей, каждая из которых уложена в отдельную субъединицу и соеденяются друг с другом нековалентными связям
По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов (КФ, EC — Enzyme Comission code). Классификация была предложена Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом:
КФ 1: Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа
КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ.
КФ 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза
КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов.
КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата.
КФ 6: Лигазы, катализирующие образование химических связей между субстратами за счет гидролиза АТФ. Пример: ДНК-полимераза
Будучи катализаторами, ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям.
По наличию в структуре фермента различных компонентов:
Простые. Они состоят только из АК.
Сложные. Они содержат белковую(апофермент) и небелковую часть(кофактор). Белок+кофакор= холофермент.
