
- •Міністерство транспорту та зв’язку україни
- •Самостійна робота № 1. Основні визначення та одиниці вимірювання фізичних величин.
- •Тепловіддачею називають процес теплообміну між твердою стінкою (тілом) і рідинним (газоподібним) середовищем, що по ній протікає.
- •Самостійна робота № 2. Теоретичні основи машинного охолодження.
- •Самостійна робота № 3. Термодинамічні основи машинного охолодження. Перший та другий закони термодинаміки.
- •Самостійна робота № 6. Повітряні холодильні машини.
- •Самостійна робота № 7. Пароежекторні і абсорбційні холодильні машини.
- •Самостійна робота № 8. Робота холодильної установки в якості теплового насосу.
- •Самостійна робота № 9. Термоелектричне охолодження .
- •Самостійна робота № 4 Принципові схеми і теплові процеси компресійних холодильних машин.
- •Самостійна робота № 5 Розрахунок теоретичного і дійсного циклів холодильної машини.
- •Самостійна робота № 10.
- •Самостійна робота № 11. Тепловий розрахунок одноступеневої холодильної машини та підбір компресора.
- •Самостійна робота № 12. Багатоступеневе стиснення та схеми холодильних машини з повним проміжним охолодженням.
- •Самостійна робота № 13. Властивості і характеристики холодоагентів.
- •Самостійна робота № 14. Вибір холодоносіїв.
- •Самостійна робота № 15. Параметри поршневих компресорів.
- •Самостійна робота № 16. Основні вузли прямоточних поршневих компресорів.
- •Самостійна робота № 17. Визначення основних параметрів поршневих компресорів.
- •Самостійна робота № 18. Регулювання холодопродуктивності компресора.
- •Самостійна робота № 19. Ротаційні, гвинтові та центробіжні компресори.
- •Самостійна робота № 20. Масла для системи мащення компресорів. Підвищення надійності та економічності компресорів.
- •Самостійна робота № 21. Компресор типу V.
- •Самостійна робота № 22.
- •Самостійна робота № 23. Характерні несправності та вимоги безпеки при обслуговуванні компресорів.
- •Самостійна робота № 24. Призначення теплообмінних апаратів холодильних установок.
- •Самостійна робота № 25. Теплопередача у випарниках і повітроохолоджувачах.
- •Самостійна робота № 26. Характерні несправності теплообмінних апаратів.
- •Самостійна робота № 27.
- •Самостійна робота № 28.
- •Самостійна робота № 29.
- •Самостійна робота № 30.
- •Самостійна робота № 31.
- •Самостійна робота № 32.
- •Самостійна робота № 33.
- •Самостійна робота № 34.
- •Самостійна робота № 35.
- •Самостійна робота № 36.
- •Самостійна робота № 37.
- •Самостійна робота № 38.
- •Самостійна робота № 39.
- •Самостійна робота № 40. Шафи-холодильники. Охолоджувачі питної води.
Самостійна робота № 3. Термодинамічні основи машинного охолодження. Перший та другий закони термодинаміки.
Перший закон термодинаміки є частковим вираженням закону збереження та перетворення енергії.
Робота перетворюється в теплоту, і, навпаки, теплота перетворюється в роботу в строго визначених еквівалентних співвідношеннях.
Математично це можна записати :
q=l, Дж.
Принцип еквівалентності теплоти і роботи, встановлений експериментально, відноситься до будь-яких можливих перетворень теплоти в роботу або роботи в теплоту.
Перший закон термодинаміки можна сформулювати так.
Підведена до пари теплота витрачається на змінену внутрішньої енергії та виконання внутрішньої роботи.
q = Δ u + l, Дж/кг,
де q – підведена теплота, Дж/кг;
Δ u – змінювання внутрішньої енергії, Дж/кг;
l – робота пари, виконана в процесі підводу теплоти, Дж/кг.
Змінювання внутрішньої енергії (Δ u )
Δ u = u2 - u1,
де u2 і u1 – внутрішня енергія пари до і після підведення теплоти, Дж/кг.
Внутрішня енергія – це сукупність кінетичної енергії молекул пари та енергії обертального та коливального рухів атомів. Всі ці види енергії залежать від температури. Із підвищенням температури внутрішня енергія збільшується.
Робота ( l ) - це зміна вмісту енергії тіла або системи. При розширенні пара здійснює роботу проти сил опору цих сил ( робота здійснюється парою). Робота – це форма передачі енергії. Коли пара здійснює роботу, вона вважається позитивною, а коли робота здійснюється парою – вона негативна.
l = P1 · S,
де P1 – сила, Н;
S – шлях, пройдений поршнем, м,
Сила P1 = p1 · Fп,
Де Fп – площа перерізу поршня, м2;
p1 – тиск на поршень, Н/м2.
Але Fп · S = v2 – v1.
Тоді P1 = p1· (v2 – v1), Дж/кг.
Ентальпія (тепломісткість) – це властивість речовини, яка вказує кількість енергії., яку можна перетворити в теплоту. Ентальпія – це термодинамічна властивість речовини, яка вказує рівень енергії, що зберігається в молекулярній структурі; хоч речовина може мати енергію на основі температури і тиску, не всю її можна перетворити в теплоту. Частина внутрішньої енергії завжди залишається в речовині і підтримує її молекулярну структуру. Частина кінетичної енергії речовини недоступна, тоді його температура наближується до температури навколишнього середовища. Ентальпія є сумую внутрішньої енергії та потенціальної енергії тиску.
і = u + p· v, Дж/кг.
Рівняння першого закону термодинаміки, виражене через ентальпію, набуде вигляду:
dq = di – vdp,
або
q = Δi – ∫ vdp ,
де Δi = Ср (Т2-Т1).
Для будь-якого термодинамічного процесу Δі або і визначаються теплоємкістю Ср і перепадом температур.
У природі всі фізичні процеси відбуваються за певними закономірностями. За звичайних умов теплові процеси відбуваються таким чином, що більш нагріті тіла віддають теплову енергію менш нагрітим. Завдяки теплообміну температури тіл, які перебувають у тепловому контакті, стають однаковими (ці висновки інколи називають нульовим законом термодинаміки).
Внаслідок механічної взаємодії змінюються координати тіл або їх швидкості. Термодинамічні процеси супроводжуються змінами станів Системи, яка характеризується певним макро- і мікро параметрами.
Ці зміни, як правило, такі, що не допускають можливість самочинного повернення системи в початковий стан. Тому самоплинні природні процеси є необоротними. Оборотними вони стають завдяки стороннім впливам або складним процесам, які компенсують ці зміни. Механічна енергія може перетворитися у внутрішню енергію( наприклад, за рахунок тертя), проте оборотний процес самочинно відбутися не може. Він стає можливим лише завдяки тепловим машинам, які роблять процес оборотним завдяки змінам у навколишньому середовищі.
Закон збереження і перетворення енергії заперечує можливість її зникнення, він нічого не каже про можливі напрями плину процесів, не забороняє перехід тепла від менш нагрітих до більш нагрітих тіл, а лише зазначає, що кількість теплоти системи при цьому має зберегтися, якщо не виконується робота.
Напрям плину теплових процесів встановлює другий закон термодинаміки, (1850р. німецький вчений Р.Клаузіус): у природі не можливий процес, під час якого теплота самочинно переходила б від менш нагрітих до більш нагрітих тіл.
Пізніше В. Том сон дав інше формування другого закону термодинаміки: неможливо здійснити такий періодичний процес, єдиним результатом якого буде виконання роботи за рахунок теплоти, відібраної у нагрівника.
Другий закон термодинаміки доповнює закон збереження і перетворення енергії в теплових процесах можливим напрямом їх самочинного перебігу в природі та заперечує можливість створення вічного двигуна.
Людство навчилося використовувати теплову енергію за допомогою теплових машин і двигунів. В основу їх дії покладено виконання механічної роботи за рахунок теплоти, яку вони отримують від нагрівач і частину якої віддають охолоджувачу.
Тепловою машиною є також холодильник, принцип дії якого ґрунтується на оборотності циклу теплової машини. Холодильна машина працює як тепловий насос: вона передає теплоту від холодного тіла до більш нагрітого (рис.1). Це не суперечить другому закону термодинаміки, оскільки охолодження відбувається за рахунок виконання роботи.
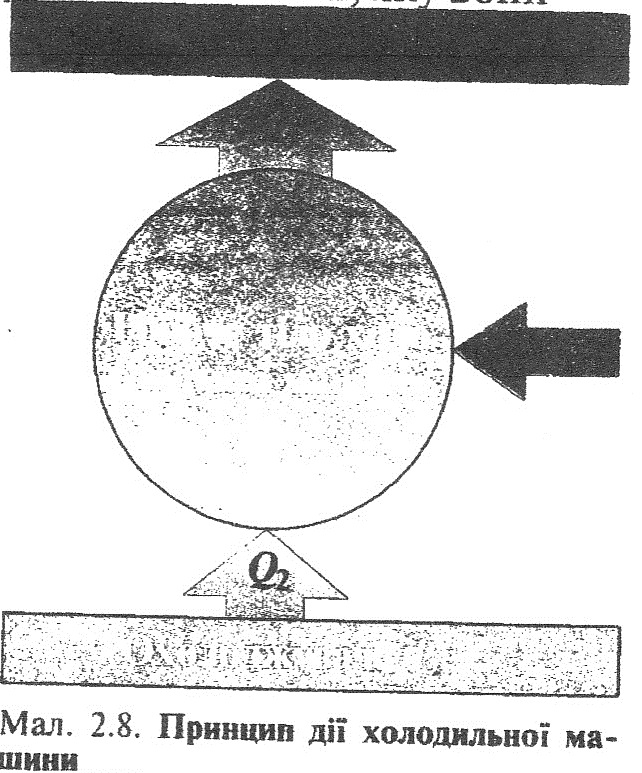
Щоб холодильну машину привести в дію, необхідно над робочим тілом виконати роботу. Тоді нагрівачу передаватиметься більша кількість теплоти, ніж відбиратиметься у
охолоджувача: Q1= Q2+А.
Таким чином, температура охолоджувача Т2 ще більше знижуватиметься, а температура нагрівача Т1 підвищуватиметься.
Ефективність холодильної машини характеризується відношенням кількості теплоти Q2, відібраної у тіла, до виконаної при цьому роботи А
= Q2/А.
Цей коефіцієнт може бути більшим за 1. Він залежить від різниці температур нагрівача Т1 і охолоджувача Т2.
У реальних холодильних машин коефіцієнт 3.
Другий закон термодинаміки дає якісну залежність – він показує шлях, по якому здійснюється найбільш ефективне, безперервне перетворення в роботу підведеної до робочого тіла теплоти.
