
Способы получения:
Соли тесно связаны со всеми остальными классами неорганических соединений и могут быть получены практически из любого класса. Большинство способов получения солей практически обсуждено выше.
Химические свойства:
Многие соли устойчивы при нагревании. Однако соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются:
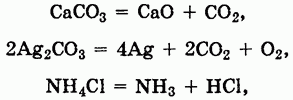
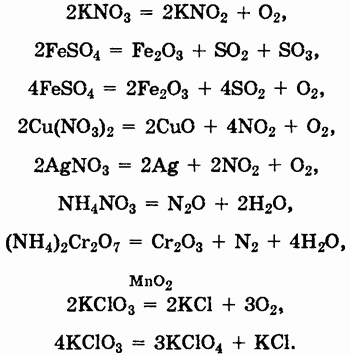
При химических реакциях солей проявляются особенности как катионов, так и анионов, входящих в их состав. Ионы металлов, находящиеся в растворах, могут вступать в реакции с другими анионами с образованием нерастворимых соединений или же в окислительно-восстановительные реакции:
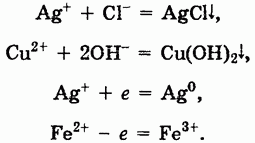
Первые две реакции показывают, что соли могут реагировать с кислотами, солями или основаниями, а вторые две указывают на окислительные и восстановительные свойства солей.
С другой стороны, анионы, входящие в состав солей, могут соединяться с катионами с образованием осадков или малодиссоциированных соединений, а также участвовать в окислительно-восстановительных реакциях:
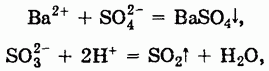

Таким образом, соли могут реагировать с солями, кислотами (по типу обмена), металлами и неметаллами.
Кислые и основные соли:
Эти соли можно рассматривать как продукт
неполного превращения кислот и оснований.
По международной номенклатуре атом
водорода, входящий в состав кислой соли,
обозначается приставкой гидро-, а группа
ОН — приставкой гидрокси-:
![]() —
гидросульфид натрия,
—
гидросульфид натрия,
![]() —
гидросульфит натрия,
—
гидросульфит натрия,
![]() —
гидроксихлорид магния,
—
гидроксихлорид магния,
![]() —
дигидроксихлорид алюминия.
—
дигидроксихлорид алюминия.
Способы получения и свойства. Кислые соли могут быть получены либо неполной нейтрализацией кислот, либо действием избытка кислот на средние соли, щелочи, оксиды или соли:
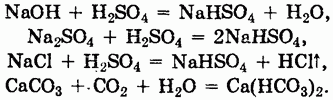
При нагревании многие кислые соли разлагаются:
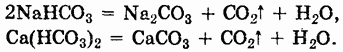
Основные соли часто получаются при осторожном добавлении небольших количеств щелочей к растворам средних солей металлов, имеющих малорастворимые основания, или при действии солей слабых кислот на средние соли:
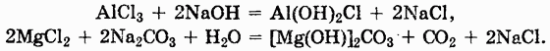
Образование кислых и средних солей имеет большое значение при объяснении процессов гидролиза.
Список Литературы:
1. Ахметов, Н.С. Общая и неорганическая химия: учеб. для вузов /
Н.С. Ахметов. - М: Высш. шк.;
2. Глинка, Н.Л. Общая химия: учеб. пособие для вузов / Н.Л. Глинка.
- М: Интеграл – Пресс;
3. Угай, ЯЛ. Общая и неорганическая химия: учеб. для вузов /
ЯЛ. Угай. - М: Высш. шк.;
4. Глинка, Н.Л. Задачи и упражнения по общей химии: учеб. пособие
для вузов / под ред. В.А. Рабиновича, Х.М. Рубиной. - М.: Интеграл -
Пресс;
5. Гольбрайх, З.Е. Сборник задач и упражнений по химии /
З.Е. Гольбрайх, Е.И. Маслов - М.: Альстрель;
6. Семенов, И.Н. Химия: учеб. для вузов / И.Н. Семенов, И.Л. Пер-
филова. - СПб.: Химиздат;
7. [Кузьменко, 1977, гл. 10];
8. [Третьяков, § 32—34];
9. [Фримантл, т. 1, гл. 8];
10. [Хомченко, 1993, гл. 6].
