
- •2. Термодинамика
- •2.1. Уравнение состояния.
- •2.2. Первый закон термодинамики.
- •2.3. Работа процесса.
- •2.4. Энтальпия.
- •2.5. Теплоемкость.
- •2.6. Термодинамические процессы.
- •2.6.1. Изохорный процесс.
- •2.6.2. Изобарный процесс.
- •2.6.3. Изотермический процесс.
- •2.6.4. Адиабатический процесс.
- •2.6.5. Политропный процесс.
- •3. Газовая динамика.
- •3.1. Скорость газа.
- •3.2. Расход газа.
- •3.3. Анализ уравнений скорости и расхода.
- •3.4. Течение газа по каналам переменного сечения.
- •3.5. Сопло Лаваля.
- •4. Теплопередача.
- •4.1. Передача теплоты через плоскую стенку.
2.6. Термодинамические процессы.
Первый закон термодинамики устанавливает связь между подведенной теплотой, внутренней энергией и работой. Уравнеие состояния определяет связь между параметрами ТРТ. Рассмотрим, что происходит с ТРТ при подводе теплоты. Очевидно предположить, что параметры изменятся. Раньше говорилось, что это изменение состояния ТРТ назвается процессом. Преобразование теплоты в работу и внутреннюю энергию зависит от вида процесса.
Ряд процессов имеет аналитическое описание:
- изохорный, при v = const,
- изобарный, при p = const,
- изотермический, при T = const,
- адиабатический, при отсутствии теплообмена q =0,
- политропный, при постоянной теплоемкости cп = const.
Практические случаи описания работы различных элементов пневмоавтоматики и пневмопривода удается подвести под тот или иной процесс и получить необходимые проектные выводы.
Анализ термодинамических процессов обычно проводится по одному шаблону:
- определяем кривую процесса на pv-диаграмме,
- определяем связь между основными параметрами состояния p1,v1,T1 и р2,v2,T2,
- определяем изменение внутренней энергии системы,
- определяем работу процесса,
- определяем изменение энтальпии,
- определяем изменение энтропии (в данном курсе понятие энтропии не рассматривается, т.к. оно необходимо, в основном, для проверки гипотез – настоящий курс прикладной и посвящен рассмотрению провереных гипотез описания процессов в элементах пневмоавтоматики). (Энтропия не убывает).
Будем считать газ идеальным.
2.6.1. Изохорный процесс.
В этом процессе v = const, следовательно dv = 0.
Из уравнения состояния получим
p/T = R/v = const,
откуда

Графически в координатах p-v процесс изображается вертикальной прямой.
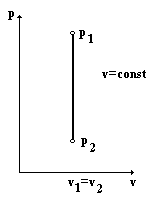
Из первого закона термодинамики следует
dq = du = cv dT, так как dv =0.
В этом процессе вся теплота идет на изменение внутренней энергии системы.
Энтальпия системы определяется i = cp dT.
2.6.2. Изобарный процесс.
В этом процессе p = const, следовательно dp = 0.
Из уравнения состояния получим
v/T = R/p = const,
откуда
![]()
это соотношение называется законом Гей-Люссака.
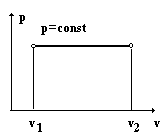
Из первого закона термодинамики следует
dq = di = cpdT, так как dp =0.
В этом процессе вся теплота идет на изменение энтальпии системы.
Энтальпия системы определяется
i = cp dT.
Внутренняя энергия системы
u = cv dT.
Работа газа в процессе
l = pdv = p(v2 - v1).
2.6.3. Изотермический процесс.
В этом процессе T = const, следовательно dT = 0.
Из уравнения состояния получим
pv = RT = const,
откуда
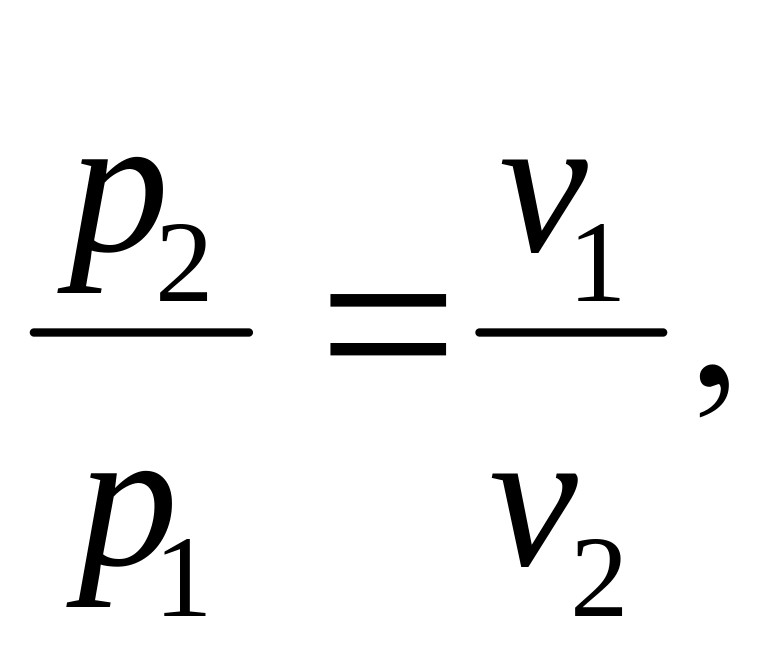
(Закон Бойля-Мариотта).
Так как внутренняя энергия и энтальпия определяются изменением температуры
du = cv dT = 0, di = cpdT = 0,
то они в этом процессе неизменны.
Из первого закона термодинамики получаем
dq
= cv
dT
+ pdv
= pdv = dl.
В этом процессе вся теплота идет на совершение работы системой.
Для определения работы процесса нужно проинтегрировать приращение работы при условии p = RT/v
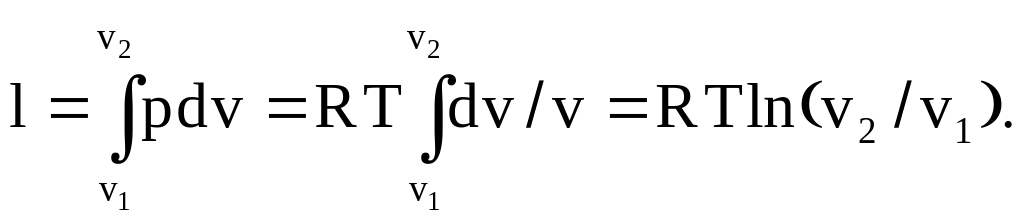
Следует отметить, что работа процесса зависит от начальных условий (T).
Так как теплоемкость есть c = dq/dT , а dT = 0, то теплоемкость этого процеса равна бесконечности. Ниже приведен график изменения параметров в процессе.

