
- •2. Термодинамика
- •2.1. Уравнение состояния.
- •2.2. Первый закон термодинамики.
- •2.3. Работа процесса.
- •2.4. Энтальпия.
- •2.5. Теплоемкость.
- •2.6. Термодинамические процессы.
- •2.6.1. Изохорный процесс.
- •2.6.2. Изобарный процесс.
- •2.6.3. Изотермический процесс.
- •2.6.4. Адиабатический процесс.
- •2.6.5. Политропный процесс.
- •3. Газовая динамика.
- •3.1. Скорость газа.
- •3.2. Расход газа.
- •3.3. Анализ уравнений скорости и расхода.
- •3.4. Течение газа по каналам переменного сечения.
- •3.5. Сопло Лаваля.
- •4. Теплопередача.
- •4.1. Передача теплоты через плоскую стенку.
2.3. Работа процесса.
Передачу энергии от одного тела к другому, связанную с изменением объема рабочего тела или с его перемещение во внешнем пространстве называют работой. В процессе работы всегда должно быть два тела. Одно тело производит работу и отдает энергию, второе тело получает энегрию и над ним совершается работа. При совершении работы изменяются параметры состояния ТРТ.
Рассмотрим частный случай - работу газа в замкнутом объеме при постоянном давлении и в равновесном процессе.
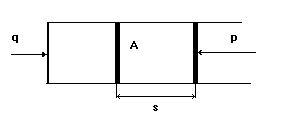
l = pAпs,
где Апs = v1 - v2
откуда
l = p(v1 - v2)
или
dl = pdv.
При произвольном процессе работа есть интеграл (при этом необходимо знать зависимость давления р от удельного объема v, которая определяется видом термодинамического процесса)

Таким образом работа процесса есть площадь под кривой процесса в координатах p,v
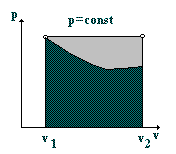
При произвольной массе газа работа будет пропорциональна массе m
L = mp(v1 - v2).
Теперь уравнение первого закона термодинамики принимает вид
dq = du + dl = du + pdv.
В дальнейшем будут получены еще ряд выражений для первого закона термодинамики. Все полученные выражения необходимо знать, поскольку они будут использоваться при выводах различных положений пневмоавтоматики.
Для произвольного канала с движущимся газом можно сделать аналогичные выводы, что
![]()
где w - скорость газа в канале.
2.4. Энтальпия.
В тепловых расчетах часто используется функция, которая по предложению Камерлинг-Онесса была названа энтальпией
|
i = u + pv
Рассмотрим выражение для первого закона термодинамики
dq = du + dl = du + pdv = du + d(pv) - vdp = d(u + pv) - vdp = di – vdp,
откуда получаем
dq = di - vdp.
Из последнего уравнения получаем, что при p = const вся подведенная теплота идет на изменение энтальпии системы.
dq = di.
Энтальпия равна энергии расширенной системы - ТРТ и окружающей среды.
Энталпия это теплосодержание системы. Энтальпия является функцией только температуры системы , так как
i = u(T) + pv = u(T) + RT.

