
Педиатрия. Майданник В.Г
..pdf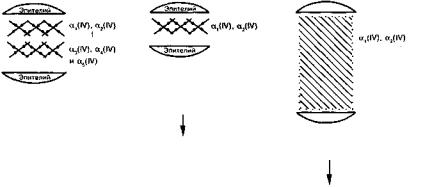
Нормальная ГБМ |
Ранний |
Поздний |
|
синдром Олпорта |
синдром Олпорта |
коллаген V типа
коллаген VI типа
Истончение базальной мембраны (ГБМ, капсула хрусталика)
|
Утолщение |
Гематурия |
и дезорганизация ГБМ |
и лентиконус |
|
|
Протеинурия и снижение функции |
|
почек |
Рис. 77. Основные этапы изменения базальных мембран гломерул при наследственном нефрите (Ф.Д. Цаликова, 1998)
4, алъфа-5 и альфа-6 цепей IV типа коллагена в базальных мембранах, тогда как возрастает количество альфа-1 и альфа-2 цепей в ГБМ. Однако механизмы этого явления неизвестны. В культуре фибробластов кожи больных Х-сцепленным синдромом Олпорта показано, что это происходит в результате только посттранскрипционных событий, поскольку уровень мРНК для альфа-1 и альфа-6 цепей IV типа коллагена не отличается от здоровых людей.
МОРФОЛОГИЯ. Указанные процессы приводят к изменению морфологии гломерул. В качестве основных светооптических признаков синдрома Олпорта признаны меньшие, чем в норме, капиллярные петли и гломерулы, похожие на «фетальные». Диффузная мезангиальная пролиферация, сегментарный или глобальный гломерулосклероз, перигломерулярный фиброз, атрофия канальцев, интерстициальный фиброз, часто в интерстиции выявляются «вспененные» клетки, но они неспецифичны. При электронной микроскопии выявляются ультраструктурные изменения гломерулярных базальных мембран, которые характеризуются истончением (особенно lamina densa), расслоением на 2 слоя или более и наличием электронно-плотных гранул диаметром около 40 нм. Дефекты в гломерулярных базальных мембранах могут иметь форму так называемых «баскетбольных корзин», изменение их толщины характерно, но не патогномонично для синдрома Олпорта. С помощью иммунофлюоресценции каких-либо изменений выявить не удается.
КЛАССИФИКАЦИЯ. В настоящее время используется классификация наследственного нефрита, предложенная М. Gubber и R. Habib (1988), согласно которой выделяют 3 варианта наследственного нефрита.
651
Для первого варианта — синдрома Олпорта — характерны нефрит с/ гематурией, тугоухостью и поражением глаз. Тип наследования — доминантный, сцепленный с Х-хромосомой. Характер течения нефрита — прогрессирующий с исходом в ХПН. При морфологическом исследовании электронно-микроскопически определяется истончение, нарушение структуры и расщепление базальной мембраны клубочка.
Второй вариант наследственного нефрита протекает без тугоухости. Тип наследования — также доминантный, сцепленный с Х-хромосомой. Характеризуется прогрессирующим течением с исходом в ХПН. При электронной микроскопии определяется истончение базальной мембраны (особенно lamina densa) клубочковых капилляров.
Третий вариант наследственного нефрита рассматривается многими авторами как семейная доброкачественная гематурия с благоприятным прогнозом. Тип наследования чаще аутосомно-рецессивный, либо ауто- сомно-доминантный. Как отмечает S. Reeders (1993), при аутосомнорецессивной форме синдрома Олпорта более тяжелое течение наблюдается у женщин.
КЛИНИКА И ДИАГНОСТИКА. Первые признаки поражения почек при синдроме Олпорта обычно выявляются в возрасте от 3 до 10 лет. В большинстве случаев симптомы заболевания выявляют случайно в виде изолированного мочевого синдрома. Наиболее частым и первым признаком заболевания является гематурия в различной степени выраженности. Но иногда ранним признаком заболевания бывает и протеинурия или реже снижение слуха. Обычно эти признаки выявляются в среднем в 6-летнем возрасте.
Гематурия при синдроме Олпорта может спонтанно как появляться, так и исчезать. Очень часто ее появление провоцируется острой респираторной вирусной инфекцией. Эритроциты в моче обычно дисморфичны и очень часто обнаруживаются эритроцитарные цилиндры. Протеинурия может отсутствовать в течение первых лет, нередко является минимальной и носит интермитирующий характер. Протеинурия более 2 г/сут определялась в 31,8% случаев у 63 пациентов с синдромом Олпорта. Возможно развитие нефротического синдрома. Вероятны варианты наследственного нефрита с тромбоцитопенией и лейомиоматозом. Первоначально выявляется лейомиома пищевода (доброкачественная опухоль, исходящая из мышечной оболочки) с преимущественной локализацией в грудной его части. Трахеобронхиальная локализация встречается реже, но она может быть причиной летального исхода вследствие бронхоспазма. Несколько позже появляются лейомиомы половых органов. Описаны случаи выявления лейомиом, локализующихся в области клитора, малых и больших половых губ.
У девочек заболевание чаще проявляется рецидивирующей гематурией. У мальчиков клиническое течение заболевания более тяжелое, чем у девочек: у 53% мальчиков и у 13% девочек развивается терминальная почечная недостаточность, в среднем, в возрасте 24,9 и 31,1 лет соответственно. К числу факторов, способствующих ухудшению состояния, относятся интеркурентные заболевания, усиление физической нагрузки, инсоляция.
652
Глухота чаще встречается у мальчиков, чем у девочек, развивается приблизительно к 10 годам. Снижение слуха выявляется у 74% мальчиков и у 5% девочек. Она имеет неврогенное происхождение и может быть выражена в различной степени, с возрастом прогрессирует (от умеренной до полной). На ранних этапах снижение слуха происходит на высоких частотах, распространяясь позднее на более низкие, переходя из звукопроводящей в звуковоспринимающую тугоухость. На ранней стадии заболевания при аудиометрии выявляется невосприимчивость звуков с частотой 6—8 кГц, а в последующем — и более низких частот (4,1—2 кГц). Поражение VIII пары черепно-мозговых нервов или кортиева органа бывает чаще двусторонним. Раннее появление этого поражения косвенно указывает на тяжесть почечного процесса. Гистологические исследования внутреннего уха выявляют различные изменения, среди которых чаще — потеря нейронов и волосяных клеток, атрофия спиральных связок, дегенерация stria vascularis. Было выдвинуто предположение, что это морфологическое разнообразие отражает присущую гетерогенность данному поражению.
У 15—30% больных с синдромом Олпорта встречаются глазные аномалии, которые проявляются изменениями полей зрения, аномалиями хрусталика и роговицы. Для синдрома Олпорта свойственны катаракты, задний лентиконус, задняя полиморфная дистрофия роговицы, псевдоотек сосочков, дистрофия сетчатки, телеангиэктазия сетчатки, нарушение цветового восприятия, колобома, страбизм, нистагм, прогрессирующий двусторонний кератоконус. Нередко выявляется нистагм и миопия. При офтальмологическом исследовании у больных с синдромом Олпорта выявляется снижение остроты зрения (в 66,7% случаев), передний лентиконус (37,8%), пятна на сетчатке (22,2%), катаракта (20%), кератоконус (6,7%). В отличие от тугоухости, передний лентиконус — хотя непостоянный, но патогномоничный признак. Макулярная и перимакулярная патология более распространена, чем лентиконус, чаще встречается у мужчин и довольно специфична для синдрома Олпорта. Отмеченные поражения обусловлены наличием в указанных структурах патологических вариантов IV типа коллагена.
При наследственном нефрите наблюдаются изменения нервной системы. Микроневрологическая симптоматика встречается у 90% больных с наследственным нефритом. Приблизительно в 30—35% случаев отмечаются симптомы вегетативно-сосудистой дисфункции — колебания АД, эмоциональная лабильность, головные боли, гипергидроз ладоней и стоп. Иногда определяются симптомы пирамидной недостаточности (гиперрефлексия и др.), сглаженность носогубных складок, асимметрия сухожильных рефлексов. Нарушения памяти и снижение интеллекта встречаются довольно редко.
Для наследственного нефрита характерны признаки дизэмбриогенеза. Обычно при экскреторной урографии иногда выявляют лоханочную эктазию, удвоенную почку, патологическую подвижность, незавершенный поворот почки.
При наследственном нефрите наблюдается снижение Т- и В-попу- ляций лимфоцитов. Часто отмечается снижение IgA, склонность к по-
653
вышению IgM и IgG. Снижена фагоцитарная активность. Снижение общей резистентности организма предрасполагает к пиелонефриту, гнойному отиту, частым простудным заболеваниям.
Функциональное состояние почек остается сохранным в стадии скрытых клинических проявлений или компенсации. В стадии субкомпенсации превалируют ренальные дисфункции по тубулярному типу, прогрессирующие в тотальную ХПН. При наследственном нефрите в биоптатах почек у детей с возрастом наблюдается увеличение соотношения интерстиций/кора и количества склерозированных гломерул, которые являются маркерами рубцевания почек. При этом выявлена отрицательная связь между клиренсом креатинина и отношением интерстиций/кора (г =—0,78; Ρ = 0,001), а также склерозированием гломерул (г =—0,74; Ρ = 0,001). Клиренс креатинина менее 80 мл/мин на 1,73 кв. м поверхности тела (пороговое значение нарушения функции почек) достоверно чаще наблюдали у больных старше 10 лет с увеличением соотношения интерстиций/кора более 0,2 (в норме 0,13 + 0,03)
иналичием более чем 10% склерозированных гломерул.
Вранние сроки заболевания установление диагноза заболевания представляет известные сложности, поскольку отсутствуют патогномоничные симптомы. Диагноз синдрома Олпорта устанавливают на основании обнаружения у ребенка нефропатии с гематурией при наличии в семье аналогичной болезни и сочетания поражения почек с глухотой у самого больного или у другого члена семьи. Поэтому для постановки диагноза важно, особенно в стадии скрытых клинических проявлений, характеризующихся гематурией и синдромом сосудистой гипотензии, составление родословной семьи больного.
Диагностическими критериями наследственного нефрита служит наличие 3 из следующих 5 признаков, один из которых относится к почкам: 1) гематурия или смерть от ХПН в семейном анамнезе; 2) гематурия или нефротический синдром у пациента; 3) изменения гломерулярных базальных мембран при электронной микроскопии биоптата почки; 4) снижение слуха по данным аудиограммы; 5) врожденная патология зрения.
Для подтверждения диагноза используют биопсию почек. При исследовании биоптата для синдрома Олпорта характерна неравномерность контуров гломерулярной базальной мембраны, расслоение или сетеобразность ее плотной пластинки при электронной микроскопии нефробиоптата у больного с гематурией.
Недавно для диагностики наследственного нефрита показана возможность исследования эпидермальных базальных мембран, которые изменяются примерно так же, как и гломерулярные.
У 10% семей с синдромом Олпорта ДНК-диагностика, чаще методом анализа конформационного полиморфизма однонитевой ДНК (метод SSCP), выявляет мутации в гене альфа-5 цепи коллагена IV типа.
ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ синдрома Олпорта производят со всеми формами хронических приобретенных заболеваний почек,
654
протекающих с гематурией, протеинурией и почечной недостаточностью, а также некоторыми формами обменных нефропатий, приобретенным гломерулонефритом, протекающим с гематурией. Для постановки диагноза наследственного нефрита решающее значение приобретают в собокупности тщательно собранный анамнез, данные клинических проявлений, лабораторного, аудиометрического, гистологического исследований.
Наиболее часто приходится дифференцировать наследственный нефрит с гломерулонефритом, течение которого сопровождается гематурией или изолированной протеинурией.
Затруднен дифференциальный диагноз синдрома Олпорта с болезнью тонких базальных мембран, для которой характерны аутосомно-доми- нантное наследование гематурии, равномерное истончение гломерулярных базальных мембран и относительно благоприятный прогноз.
При болезни Шарко—Мари—Тута семейное сочетание нефропатий, тугоухости, фокально-сегментарного гломерулосклероза и расслоения плотной пластинки гломерулярных базальных мембран сопровождается мышечной атрофией.
Нефропатия и тугоухость при синдроме Branchio—Oto— Renal сочетается с рудиментарными остатками жаберных щелей. Для синдрома Макла—Уэльса характерны аутосомно-доминантное наследование, повышение СОЭ, частое развитие хронической почечной недостаточности, озноб и уртикарная сыпь (в дебюте), тугоухость, глаукома и нефротический синдром (впоследствии). При синдроме Альстрема пигментная дегенерация сетчатки, нейросенсорная тугоухость и нефропатия сочетаются с сахарным диабетом и ожирением.
ЛЕЧЕНИЕ. До настоящего времени отсутствуют эффективные методы патогенетической терапии наследственного нефрита. Лечение предусматривает организацию щадящего режима. Ограничиваются физические нагрузки, не проводятся профилактические прививки. Диета высококалорийная, сбалансированная, составляется с учетом функционального состояния почек. При отсутствии признаков нарушения функции почек используется диета с достаточным содержанием белков, жиров и углеводов. Но диета с ограничением белков, липидов, кальция и фосфора отдаляет сроки развития хронической почечной недостаточности.
Недавно сообщено об успешном применении в комплексном лечении наследственного нефрита ингибиторов ангиотензин-превращающего фермента (АПФ), которые уменьшали выраженность протеинурии и замедляли прогрессирование заболевания.
Используют также активаторы обмена, такие как пиридоксин (по 2—3 мг/кг в сутки в 3 приема 2—4 нед), кокарбоксилазу (по 50 мг внутримышечно через день 10—15 инъекций), АТФ (по 1 мл внутримышечно через день 10—15 инъекций), витамин А (по 1000 ЕД/год жизни/сут в 1 прием 10—14 дней), витамин Ε (по 1 мг/кг/сут в 1 прием 10—14 дней). Указанные препараты применяют курсами 2—3 раза в год. Используют также фитотерапию. В качестве иммуностимуляторов назначают лева-
655
мизол (декарис) в дозе 2 мг/кг/сут 2—3 раза в неделю с 4-дневным пере-/ рывом. У В последнее время все больше и больше исследователей высказывают мнение о высокой эффективности трансплантации почек при наследственном нефрите. Гломерулярная патология, свойственная синдрому Олпорта, в трансплантате не развивается, но очень редко (у 5% больных) в трансплантате может возникать нефрит, связанный с антителами к ГБМ. Успех диализа и трансплантации зависит от подбора трансплантата и наличия антител к ГБМ, представляющих риск для развития посттрансплантационного нефрита. Отмечено прекращение прогресси-
рования тугоухости после трансплантации почек.
Антибактериальная, иммуносупрессивная и стероидная терапия оправданы в ведении больных в пред- и посттрансплантационный периоды. Хотя существуют данные об эффективности циклоспорина при синдроме Олпорта у пациентов с нефротическим синдромом, что проявляется снижением протеинурии, патогенетического обоснования этому пока не находят.
Коррекцию зрения проводят с помощью очков или контактных линз. Описан положительный опыт имплантации хрусталика и оперативного лечения переднего лентиконуса.
Идентификация в 1985 г. в качестве генетической основы наследственного нефрита мутации в гене коллагена IV типа стала исторической вехой в нефрологии и повлекла за собой десятки генетических, морфологических и биохимических исследований, поставила новые задачи ранней диагностики заболевания перед клиницистами. В будущем построение генетического консультирования, очевидно, будет основываться на пренатальной ДНК-диагностике синдрома Олпорта, а в лечении этого заболевания будет использоваться генная терапия. В частности, недавно была предпринята попытка переноса нормальных генов в гломерулярные клетки. Для этого в гломерулы свиньи в условиях in vivo были перенесены гены, ответственные за синтез альфа-5 цепи IV типа коллагена, предварительно трансформированные аденовирусами, содержащими бета-галак- тозидазу. В результате перфузии почек в 85% гломерул обнаружена экспрессия трансгенов. В ближайшем будущем планируются эксперименты по генной терапии на модели синдрома Олпорта у собак.
ПРОГНОЗ. Все больные с наследственным нефритом находятся на диспансерном учете в течение всей жизни. Прогностически неблагоприятными критериями течения наследственного нефрита являются принадлежность к мужскому полу, раннее развитие ХПН в семье, протеинурия более 1 г/сут, утолщение гломерулярных базальных мембран при электронной микроскопии, неврит слухового нерва и делеция в гене COL4A5. С целью определения прогноза некоторые авторы рекомендуют исследовать с помощью моноклональных антител к альфа-5 цепи IV типа коллагена в реакции непрямой иммунофлюоресценции экспрессию аль- фа-5 цепей в базальных мембранах кожи, поскольку была установлена сильная отрицательная корреляционная связь (г = 0,71; Ρ = 0,0001) между наличием альфа-5 цепей и тяжестью заболевания.
656
НЕФРОТИЧЕСКИЙ СИНДРОМ
\ Нефротический синдром занимает особое место в детской нефрологии, поскольку это понятие собирательное и неоднородное по этиологии и Патогенезу. Рассмотрим нефротический синдром не как самостоятельную нозологическую форму почечной патологии, а как симптомокомплекс, который может сопровождать течение различных заболеваний и поэтому с различной частотой наблюдается при многих заболеваниях почек у детей.
Нефротический синдром — это клинико-лабораторный симптомокомплекс, включающий выраженные отеки, массивную протеинурию (более 2,5 г/сут), гипопротеинемию (менее 40 г/л), гипоальбуминемию (менее 30 г/л) и гиперлипидемию.
Термин «нефротический синдром» был введен в нефрологическую литературу Nonnenbruch в 1949 году, а с 1968 года нефротический синдром включен экспертами ВОЗ в номенклатуру болезней. Причем в Международной классификации болезней (МКБ—10, Женева, 1995) нефротический синдром выделен как самостоятельная нозологическая форма. Он рассматривается в рубрике 581.
ЭПИДЕМИОЛОГИЯ. Нефротический синдром может сопровождать течение многих заболеваний почек и поэтому возникает у детей любого возраста. Но статистические данные свидетельствуют, что он встречается чаще у детей в возрасте 2—5 лет. В нашем регионе нефротический синдром встречается значительно реже у детей грудного возраста. Это связано с тем, что в грудном возрасте нефротический синдром имеет врожденный характер и обусловлен, как правило, микрокистозом почек финского типа. Это заболевание является наследственным, передается по аутосомно-рецессивному типу и у лиц нефинской национальности встречается чрезвычайно редко. Так, если его частота в Финляндии составляет 10—12,5 на 100 тыс. новорожденных, то в Белоруссии — только 0,57 на 100 тыс. новорожденных. В Украине описаны единичные случаи врожденного нефротического синдрома у детей.
ЭТИОЛОГИЯ. К большому сожалению, в каждом конкретном случае бывает очень трудно установить причину. В качестве этиологических факторов могут выступать вирусные инфекции, токсико-инфекционные процессы и хронические интоксикации, тонзиллярные стрептококковые и стафилококковые поражения, алллергические заболевания, эндогенные интоксикации на почве расстройств процессов обмена.
Нефротический синдром может развиваться при наследственных, врожденных заболеваниях, болезнях иммунной, аллергической, метаболической, бактериальной, вирусной и паразитарной природы. Довольно часто (в 25—30% случаев) предшествующие причины нефротического синдрома установить вообще не удается.
Первичный нефротический синдром может возникать вследствие гломерулонефрита, микрокистоза почек, первичного амилоидоза, а так-
657
же развиваться как семейный нефротический синдром и липоидный нефроз. Вторичный нефротический синдром может развиваться при общих болезнях (вторичный амилоидоз, периодическая болезнь, системная красная волчанка, узелковый периартериит, дерматомиозиТ, геморрагический васкулит, сахарный диабет, лимфогрануломатоз, м^- елома), болезнях обмена (гликогеноз, цистиноз, нефролитиаз и др.), вследствие нарушения циркуляции (тромбоз почечных вен и артерий, недостаточность кровообращения, врожденные пороки сердца и др.), при интоксикациях (тяжелые металлы, пеницилламин, сыворотки и вакцины и т.д.), вследствие инфекций и паразитарных болезней (гепатит, сифилис, туберкулез, малярия и т.д.).
Существует возможность появления нефротического синдрома при аллергических (атопических) заболеваниях типа поллинозов, аллергии на химические вещества, пищевой идиосинкразии. Детальный перечень факторов, которые могут быть причиной возникновения нефротического синдрома у детей, представлен на рисунке 78.
КЛАССИФИКАЦИЯ. Многообразие причин, приводящих к возникновению нефротического синдрома, требует выделения классификационных групп в соответствии с существующей классификацией для того, чтобы поставить индивидуальный диагноз каждому больному.
В настоящее время в детской нефрологии не существует общепринятой классификации нефротического синдрома. Наиболее полная классификационная схема нефротического синдрома у детей была представлена профессором М.П. Матвеевым в 1975 году. Один из ведущих детских нефрологов России профессор М.С. Игнатова придерживается мнения, что эта систематика нефротического синдрома у детей приемлема. Однако некоторые детские нефрологи считают, что недостаток классификации М.П. Матвеева заключается в отождествлении терминов «нефротический синдром, связанный с минимальными изменениями гломерул», и «нефротическая форма гломерулонефрита».
Именно поэтому известный нефролог профессор А.В. Папаян и соавторы (1990) предложили классификацию нефротического синдрома у детей, которая основана на особенностях происхождения, клинико-мор- фологических особенностях, оценке степени тяжести и характера течения заболевания, вариантов ответа на стероидную терапию, состояние функции почек (рис. 79).
Согласно этой классификации различают первичный и вторичный нефротический синдром. Первичные формы составляют 85—90% всех случаев нефротического синдрома у детей и обусловлены липоидным нефрозом, первичным гломерулонефритом, врожденным и семейным нефротическим синдромом, первичным амилоидозом. Вторичный нефротический синдром (10—15%) возникает на фоне системных (вторичный амилоидоз, периодическая болезнь, системная красная волчанка, узелковый периартериит, геморрагический васкулит, сахарный диабет и др.) и прочих заболеваний (аллергические, обменные, интоксикации и др.). При отсутствии возможности определить причину нефротического синдрома с помощью доступных методов устанавливают диагноз идиопатического нефротического синдрома.
658

Первичный нефротический синдром
Без гломерулонефрита
Липоидный нефроз (минимальные изменения гломерул) Врожденный нефротический синдром Фокально-сегментарный гломерулосклероз
Вследствие гломерулонефрита
Мезангио-пролиферативный гломерулонефрит Мембраннозно-пролиферативный гломерулонефрит Мембранозная нефропатия Острый постинфекционный гломерулонефрит
Вторичный нефротический синдром
Вследствие инфекций
Вирусы (гепатит, цитомегаловирус, вирус Эпштейна — Барра и др.) Бактерии (подострый бактериальный эндокардит и др.) Паразиты (малярия и др.)
Опухолевые заболевания
Лимфома, лейкоз, лимфогрануломатоз Карционома, опухоль Вильмса и др.
Болезни обмена
Сахарный диабет Гипотиреоидизм Цистиноз Гликогеноз
Воспалительные заболевания
Системная красная волчанка Геморрагический васкулит Узелковый периартериит
Другие нарушения
Тромбоз почечных вен и артерий Гемолитико-уремический синдром Амилоидоз Периодическая болезнь
Экзогенные агенты
Аллергены (поллинозы, пищевая аллергия) Вакцины (АКДС, гамма-глобулин и др.)
Токсические вещества (ртуть, свинец, золото, наркотики и др.) Лекарственные вещества (каптоприл, пеницилламин и др.)
Рис. 78. Возможные причины нефротического синдрома у детей
659

|
Первичный нефротическии синдром |
|
|
Морфологический тип изменений |
|
Врожденный |
Врожденный. «Финский» тип — микрокистоз; |
|
и наследственный |
диффузный мезангиальный склероз |
|
|
Семейный. Экстрамембранозный, мембранозно- |
|
|
пролиферативный, ФСГС, мезангио-пролифера- |
|
|
тивный, диффузный мезангиальный склероз |
|
|
Нефротический вариант наследственного нефрита. |
|
|
Диспластический, дистрофический, пролифера- |
|
|
тивный, фокально-сегментарный склероз |
|
|
Нефропатическая форма |
первичного амилоидоза. |
|
Амилоидоз, паренхиматозный тип |
|
|
ГНМИ-липоидный нефроз. |
Минимальные изменения |
|
клубочков; при электронной микроскопии |
|
|
изменения подоцитов |
|
При |
Нефротическая и смешанная формы гломеруло- |
|
гломерулонефрите |
нефрита. Мембранозный, ФСГС, мезангио-проли- |
|
|
феративный, мезангио-капиллярный (мембранозно- |
|
|
пролиферативный), лобулярный, пролиферативный, |
|
|
экстракапиллярный с «полулуниями», фибропласти- |
|
|
ческий |
|
Вторичный нефротическии синдром
Врожденный тип: при цитомега- |
Эпимембранозный, мембранозный, |
|
лии, токсоплазмозе, сифилисе, |
пролиферативный, тромботический, |
|
туберкулезе, тромбозе почечных |
ФСГС |
|
вен, опухоли Вильмса и нефро- |
|
|
бластоме |
|
|
|
|
|
При |
наследственных заболева- |
Эндо- и экстракапиллярный пролифе- |
ниях: синдромах Олпорта, |
ративный; мембранозно-пролифера- |
|
липодистрофии, спондило- |
тивный; ФСГС |
|
эпифизарной дисплазии |
|
|
|
|
|
При почечном дизэмбриогенезе |
Дисплазия, незрелость, нарушение |
|
|
|
дифференцировки почечной ткани |
|
|
|
При |
коллагенозах |
Специфические и неспецифические |
|
|
черты нефропатии: мембранозный, |
|
|
мембранозно-пролиферативный, |
|
|
мезангио-капиллярный, экстра- |
|
|
капиллярный, фибропластический |
|
|
|
При |
системных васкулитах |
Фокально-сегментарный, тромботи- |
|
|
ческий, мембранозно-пролифератив- |
|
|
ный, мезангио-капиллярный, экстра- |
|
|
капиллярный, фибропластический |
|
|
|
|
Рис. 79. Классификация нефротического синдрома у детей |
|
|
(А.В. Папаян и соавторы, 1990) |
|
660
