
- •Содержание
- •Конформации элементарных звеньев и макромолекулы целлюлозы в целом.
- •Синтез простых эфиров алкилированием целлюлозы непредельными соединениями.
- •Строение белков: первичная, вторичная, третичная и четвертичная структура белков.
- •Рассчитать степень замещения аллилцианэтилцеллюлозы, если элементный состав полученного продукта был следующий: углерода – 52%, азота – 5,02%.
- •Напишите схему получения циандезоксицеллюлозы
- •Список использованных источников
Строение белков: первичная, вторичная, третичная и четвертичная структура белков.
Среди органических веществ белки, или протеины, – самые многочисленные, наиболее разнообразные и имеющие первостепенное значение биополимеры. На их долю приходится 50 - 80% сухой массы клетки. /5, с.19/
Белки подразделяют на протеины (простые белки) и протеиды (сложные белки).
Молекулы белков имеют большие размеры, поэтому их называют макромолекулами. Кроме углерода, кислорода, водорода и азота, в состав белков могут входить сера, фосфор и железо. Белки отличаются друг от друга числом (от ста до нескольких тысяч), составом и последовательностью мономеров. Мономерами белков являются аминокислоты (рисунок 4).
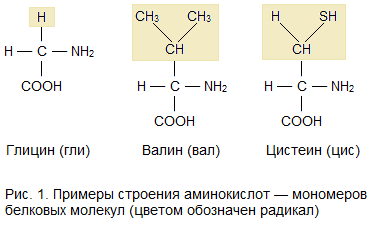
Рисунок 4 – Примеры строения аминокислот – мономеров белковых молекул (цветом обозначен радикал)
Бесконечное разнообразие белков создается за счет различного сочетания всего 20 аминокислот. Каждая аминокислота имеет свое название, особое строение и свойства. Их общую формулу можно представить в следующем виде:
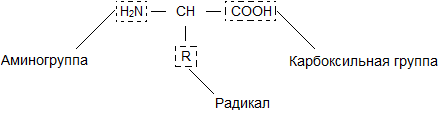
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (-NH2) с основными свойствами, другая – карбоксильной группой (-COOH) с кислотными свойствами. Часть молекулы, называемая радикалом (R), у разных аминокислот имеет различное строение. Наличие в одной молекуле аминокислоты основной и кислотной групп обусловливает их высокую реакционную способность. Через эти группы происходит соединение аминокислот при образовании белка. При этом возникает молекула воды, а освободившиеся электроны образуют пептидную связь. Поэтому белки называют полипептидами. /5, с.21/
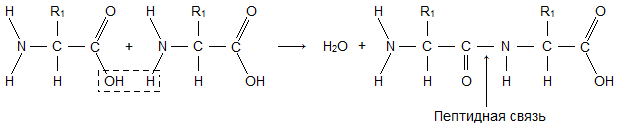
Молекулы белков могут иметь различные пространственные конфигурации, и в их строении различают четыре уровня структурной организации.
Первичная структура белка.
Первичной структурой белков называется линейная полипептидная цепь из аминокислот, соединенных между собой пептидными связями. Первичная структура – простейший уровень структурной организации белковой молекулы. Высокую стабильность ей придают ковалентные пептидные связи между α-аминогруппой одной аминокислоты и α-карбоксильной группой другой аминокислоты.
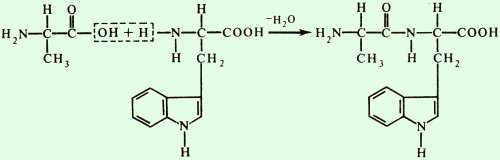
Если в образовании пептидной связи участвует иминогруппа пролина или гидроксипролина, то она имеет другой вид.

При образовании пептидных связей в клетках сначала активируется карбоксильная группа одной аминокислоты, а затем она соединяется с аминогруппой другой. Примерно так же проводят лабораторный синтез полипептидов.
Пептидная связь является повторяющимся фрагментом полипептидной цепи. Она имеет ряд особенностей, которые влияют не только на форму первичной структуры, но и на высшие уровни организации полипептидной цепи /5, с.23/:
копланарность – все атомы, входящие в пептидную группу, находятся в одной плоскости;
способность существовать в двух резонансных формах (кето- или енольной форме);
транс-положение заместителей по отношению к С-N-связи;
способность к образованию водородных связей, причем каждая из пептидных групп может образовывать две водородные связи с другими группами, в том числе и пептидными.
Исключение составляют пептидные группы с участием аминогруппы пролина или гидроксипролина. Они способны образовывать только одну водородную связь (см. выше). Это сказывается на формировании вторичной структуры белка. Полипептидная цепь на участке, где находится пролин или гидроксипролин, легко изгибается, так как не удерживается, как обычно, второй водородной связью.
Номенклатура пептидов и полипептидов.
Название пептидов складывается из названий входящих в них аминокислот. Две аминокислоты дают дипептид, три – трипептид, четыре – тетрапептид и т. д. Каждый пептид или полипептидная цепь любой длины имеет N-концевую аминокислоту, содержащую свободную аминогруппу, и С-концевую аминокислоту, содержащую свободную карбоксильную группу. Называя полипептиды, перечисляют последовательно все аминокислоты, начиная с N-концевой, заменяя в их названиях, кроме С-концевой, суффикс -ин на -ил (так как аминокислоты в пептидах имеют уже не карбоксильную группу, а карбонильную). Например, название изображенного на рисунке 5 трипептида – лейцилфенилаланилтреонин.
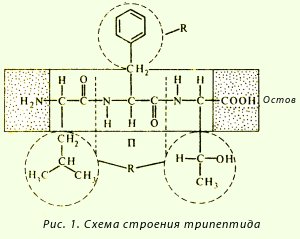
Рисунок 5 –Схема строения трипептида
Особенности первичной структуры белка.
В остове полипептидной цепи чередуются жесткие структуры (плоские пептидные группы) с относительно подвижными участками (-СНR), которые способны вращаться вокруг связей. Такие особенности строения полипептидной цепи влияют на укладку ее в пространстве. /5, с.25/
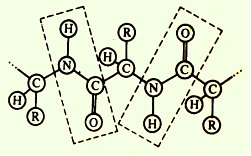
Рисунок 6 – Первичная структура белка
Вторичная структура белка.
Вторичная структура представляет собой способ укладки полипептидной цепи в упорядоченную структуру благодаря образованию водородных связей между пептидными группами одной цепи или смежными полипептидными цепями. По конфигурации вторичные структуры делятся на спиральные (α-спираль) и слоисто-складчатые (β-структура и кросс-β-форма).
α-Спираль. Это разновидность вторичной структуры белка, имеющая вид регулярной спирали, образующейся благодаря межпептидным водородным связям в пределах одной полипептидной цепи. Модель строения α-спирали (рисунок 7), учитывающая все свойства пептидной связи, была предложена Полингом и Кори. Основные особенности α-спирали /5, с.26/:
спиральная конфигурация полипептидной цепи, имеющая винтовую симметрию;
образование водородных связей между пептидными группами каждого первого и четвертого аминокислотных остатков;
регулярность витков спирали;
равнозначность всех аминокислотных остатков в α-спирали независимо от строения их боковых радикалов;
боковые радикалы аминокислот не участвуют в образовании α-спирали.
Внешне α-спираль похожа на слегка растянутую спираль электрической плитки. Регулярность водородных связей между первой и четвертой пептидными группами определяет и регулярность витков полипептидной цепи. Высота одного витка, или шаг α-спирали, равна 0,54 нм; в него входит 3,6 аминокислотных остатка, т. е. каждый аминокислотный остаток перемещается вдоль оси (высота одного аминокислотного остатка) на 0,15 нм (0,54:3,6 = 0,15 нм), что и позволяет говорить о равнозначности всех аминокислотных остатков в α-спирали. Период регулярности α-спирали равен 5 виткам или 18 аминокислотным остаткам; длина одного периода составляет 2,7 нм.
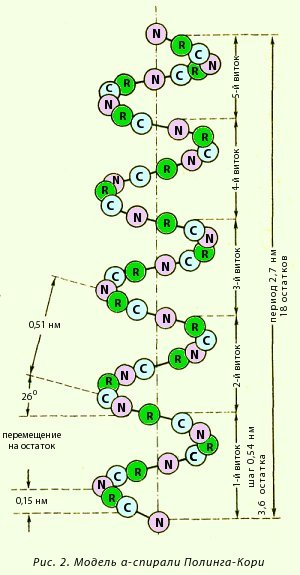
Рисунок 7 – Модель α-спирали Полинга-Кори
β-Структура. Это разновидность вторичной структуры, которая имеет слабо изогнутую конфигурацию полипептидной цепи и формируется с помощью межпептидных водородных связей в пределах отдельных участков одной полипептидной цепи или смежных полипептидных цепей. Ее называют также слоисто-складчатой структурой. Имеются разновидности β-структур. Ограниченные слоистые участки, образуемые одной полипептидной цепью белка, называют кросс-β-формой (короткая β-структура). Водородные связи в кросс-β-форме образуются между пептидными группами петель полипептидной цепи. Другой тип — полная β-структура – характерен для всей полипептидной цепочки, которая имеет вытянутую форму и удерживается межпептидными водородными связями между смежными параллельными полипептидными цепями (рисунок 8). Эта структура напоминает меха аккордеона. Причем возможны варианты β-структур: они могут быть образованы параллельными цепями (N-концы полипептидных цепей направлены в одну и ту же сторону) и антипараллельными (N-концы направлены в разные стороны). Боковые радикалы одного слоя помещаются между боковыми радикалами другого слоя. /5, с.28/
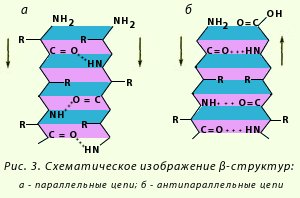
а – параллелбные цепи; б – антипараллельные цепи
Рисунок 8 – Схематическое изображение β-структур
В белках возможны переходы от α-структур к β-структурам и обратно вследствие перестройки водородных связей. Вместо регулярных межпептидных водородных связей вдоль цепи (благодаря им полипептидная цепь скручивается в спираль) происходит раскручивание спирализованных участков и замыкание водородных связей между вытянутыми фрагментами полипептидных цепей. Такой переход обнаружен в кератине – белке волос. При мытье волос щелочными моющими средствами легко разрушается спиральная структура β-кератина и он переходит в α-кератин (вьющиеся волосы распрямляются).
Разрушение регулярных вторичных структур белков (α-спирали и β-структур) по аналогии с плавлением кристалла называют "плавлением" полипептидов. При этом водородные связи рвутся, и полипептидные цепи принимают форму беспорядочного клубка. Следовательно, стабильность вторичных структур определяется межпептидными водородными связями. Остальные типы связей почти не принимают в этом участия, за исключением дисульфидных связей вдоль полипептидной цепи в местах расположения остатков цистеина. Короткие пептиды благодаря дисульфидным связям замыкаются в циклы. Во многих белках одновременно имеются α-спиральные участки и β-структуры. Природных белков, состоящих на 100% из α-спирали, почти не бывает (исключение составляет парамиозин – мышечный белок, на 96-100% представляющий собой α-спираль), тогда как у синтетических полипептидов 100%-ная спирализация.
Другие белки имеют неодинаковую степень спирализации. Высокая частота α-спиральных структур наблюдается у парамиозина, миоглобина, гемоглобина. Напротив, у трипсина, рибонуклеазы значительная часть полипептидной цепи укладывается в слоистые β-структуры. Белки опорных тканей: кератин (белок волос, шерсти), коллаген (белок сухожилий, кожи), фиброин (белок натурального шелка) имеют β-конфигурацию полипептидных цепей. Разная степень спирализации полипептидных цепей белков говорит о том, что, очевидно, имеются силы, частично нарушающие спирализацию или "ломающие" регулярную укладку полипептидной цепи. Причиной этого является более компактная укладка полипептидной цепи белка в определенном объеме, т. е. в третичную структуру.
Третичная структура белка.
Третичной структурой белка называется способ укладки полипептидной цепи в пространстве. По форме третичной структуры белки делятся в основном на глобулярные и фибриллярные. Глобулярные белки чаще всего имеют эллипсовидную форму, а фибриллярные (нитевидные) белки – вытянутую (форма палочки, веретена). /5, с.30/
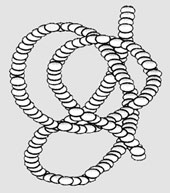
Рисунок 9 – Глобулярная третичная структура белка
Однако конфигурация третичной структуры белков еще не дает основания думать, что фибриллярные белки имеют только β-структуру, а глобулярные α-спиральные. Есть фибриллярные белки, имеющие спиральную, а не слоисто-складчатую вторичную структуру. Например, α-кератин и парамиозин (белок запирательной мышцы моллюсков), тропомиозины (белки скелетных мышц) относятся к фибриллярным белкам (имеют палочковидную форму), а вторичная структура у них – α-спираль; напротив, в глобулярных белках может быть большое количество β-структур.
Спирализация линейной полипептидной цепи уменьшает ее размеры примерно в 4 раза; а укладка в третичную структуру делает ее в десятки раз более компактной, чем исходная цепь.
Связи, стабилизирующие третичную структуру белка. В стабилизации третичной структуры играют роль связи между боковыми радикалами аминокислот. Эти связи можно разделить на /5, с.31/:
сильные (ковалентные).
К ковалентным связям относятся дисульфидные связи (-S-S-) между боковыми радикалами цистеинов, находящихся в разных участках полипептидной цепи; изопептидные, или псевдопептидные, – между аминогруппами боковых радикалов лизина, аргинина, а не α-аминогруппами, и СООН-группами боковых радикалов аспарагиновой, глутаминовой и аминолимонной кислот, а не α-карбоксильными группами аминокислот. Отсюда и название этого типа связи — подобная пептидной. Редко встречается эфирная связь, образуемая СООН-группой дикарбоновых аминокислот (аспарагиновой, глутаминовой) и ОН-группой гидроксиаминокислот (серина, треонина).
слабые (полярные и ван-дер-ваальсовы).
К полярным связям относятся водородные и ионные. Водородные связи, как обычно, возникают между группой -NН2, -ОН или -SН бокового радикала одной аминокислоты и карбоксильной группой другой. Ионные, или электростатические, связи образуются при контакте заряженных групп боковых радикалов —NН3+ (лизина, аргинина, гистидина) и -СОО- (аспарагиновой и глутаминовой кислот).
Неполярные, или ван-дер-ваальсовы, связи образуются между углеводородными радикалами аминокислот. Гидрофобные радикалы аминокислот аланина, валина, изолейцина, метионина, фенилаланина в водной среде взаимодействуют друг с другом. Слабые ван-дер-ваальсовы связи способствуют формированию гидрофобного ядра из неполярных радикалов внутри белковой глобулы. Чем больше неполярных аминокислот, тем большую роль в укладке полипептидной цепи играют ван-дер-ваальсовы связи.
Многочисленные связи между боковыми радикалами аминокислот определяют пространственную конфигурацию белковой молекулы.
Особенности организации третичной структуры белка.
Конформация третичной структуры полипептидной цепи определяется свойствами боковых радикалов входящих в нее аминокислот (которые не оказывают заметного влияния на формирование первичной и вторичной структур) и микроокружением, т. е. средой. При укладке полипептидная цепь белка стремится принять энергетически выгодную форму, характеризующуюся минимумом свободной энергии. Поэтому неполярные R-группы, "избегая" воды, образуют как бы внутреннюю часть третичной структуры белка, где расположена основная часть гидрофобных остатков полипептидной цепи. В центре белковой глобулы почти нет молекул воды. Полярные (гидрофильные) R-группы аминокислоты располагаются снаружи этого гидрофобного ядра и окружены молекулами воды. Полипептидная цепь причудливо изгибается в трехмерном пространстве. При ее изгибах нарушается вторичная спиральная конформация. "Ломается" цепь в слабых точках, где находятся пролин или гидроксипролин, поскольку эти аминокислоты более подвижны в цепи, образуя только одну водородную связь с другими пептидными группами. Другим местом изгиба является глицин, R-группа которого мала (водород). Поэтому R-группы других аминокислот при укладке стремятся занять свободное пространство в месте нахождения глицина. Ряд аминокислот - аланин, лейцин, глутамат, гистидин – способствуют сохранению устойчивых спиральных структур в белке, а такие, как метионин, валин, изолейцин, аспарагиновая кислота, благоприятствуют образованию β-структур. В молекуле белка с третичной конфигурацией встречаются участки в виде α-спиралей (спирализованные), β-структур (слоистые) и беспорядочного клубка. Только правильная пространственная укладка белка делает его активным; нарушение ее приводит к изменению свойств белка и потере биологической активности. /5, с.32/
Четвертичная структура белка.
Белки, состоящие из одной полипептидной цепи, имеют только третичную структуру. К ним относятся миоглобин – белок мышечной ткани, участвующий в связывании кислорода, ряд ферментов (лизоцим, пепсин, трипсин и т. д.). Однако некоторые белки построены из нескольких полипептидных цепей, каждая из которых имеет третичную структуру. Для таких белков введено понятие четвертичной структуры, которая представляет собой организацию нескольких полипептидных цепей с третичной структурой в единую функциональную молекулу белка. Такой белок с четвертичной структурой называется олигомером, а его полипептидные цепи с третичной структурой – протомерами или субъединицами (рисунок 10).
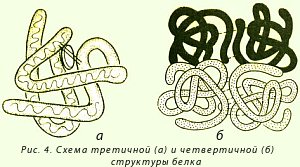
Рисунок 10 – Схема третичной (а) и четвертичной (б) структуры белка
При четвертичном уровне организации белки сохраняют основную конфигурацию третичной структуры (глобулярную или фибриллярную). Например, гемоглобин – белок, имеющий четвертичную структуру, состоит из четырех субъединиц. Каждая из субъединиц – глобулярный белок и, в целом, гемоглобин тоже имеет глобулярную конфигурацию. Белки волос и шерсти - кератины, относящиеся по третичной структуре к фибриллярным белкам, имеют фибриллярную конформацию и четвертичную структуру. /5, с.33/
Стабилизация четвертичной структуры белков.
Все белки, у которых обнаружена четвертичная структура, выделены в виде индивидуальных макромолекул, не распадающихся на субъединицы. Контакты между поверхностями субъединиц возможны только за счет полярных групп аминокислотных остатков, поскольку при формировании третичной структуры каждой из полипептидных цепей боковые радикалы неполярных аминокислот (составляющих большую часть всех протеиногенных аминокислот) спрятаны внутри субъединицы. Между их полярными группами образуются многочисленные ионные (солевые), водородные, а в некоторых случаях и дисульфидные связи, которые прочно удерживают субъединицы в виде организованного комплекса. Применение веществ, разрывающих водородные связи, или веществ, восстанавливающих дисульфидные мостики, вызывает дезагрегацию протомеров и разрушение четвертичной структуры белка. В таблице 1 суммированы данные о связях, стабилизирующих разные уровни организации белковой молекулы. /5, с.34/
Уровень организации |
Типы связей (по прочности) |
Разновидность связи |
Первичная (линейная полипeптидная цепь) |
Ковалентные (сильные) |
Пептидная – между α-амино- и α-карбоксильными группами аминокислот |
Вторичная (α-спираль, β-структуры) |
Слабые |
Водородные – между пептидными группами (каждой первой и четвертой) одной полипептидной цепи или между пептидными группами смежных полипептидных цепей |
Ковалентные (сильные) |
Дисульфидные – дисульфидные петли в пределах линейного участка полипептидной цепи |
|
Третичная (глобулярная, фибриллярная) |
Ковалентные (сильные) |
Дисульфидные, изопептидные, сложноэфирные – между боковыми радикалами аминокислот разных участков полипептидной цепи |
Слабые |
Водородные – между боковыми радикалами аминокислот разных участков полипептидной цепи Ионные (солевые) – между противоположно заряженными группами боковых радикалов аминокислот полипептидной цепи Ван-дер-ваальсовы – между неполярными боковыми радикалами аминокислот полипептидной цепи |
|
Четвертичная (глобулярная, фибриллярная) |
Слабые |
Ионные – между противоположно заряженными группами боковых радикалов аминокислот каждой из субъединиц Водородные – между боковыми радикалами аминокислотных остатков, расположенными на поверхности контактирующих участков субъединиц |
Ковалентные (сильные) |
Дисульфидные – между остатками цистеина каждой из контактирующих поверхностей разных субъединиц |
Таблица 1 – Характеристика связей, участвующих в структурной организации белков
Для определения небольшого содержания карбоксильных групп в целлюлозном препарате применяют реакцию с о-нитрофенолятом серебра. После обработки навески целлюлозы, равной 5,3184 г с влажностью 8%, в целлюлозе выделено 0,0981 г серебра. Вычислить содержание карбоксильных групп и кислотное число целлюлозы.
Решение.
При небольшом содержании НООС- групп в целлюлозном препарате (не более 0,5 %) используется реакция обменного осаждения с о-нитрофенолятом серебра, протекающая по схеме /6, с.304/:
С еll-СООН
+ АgОС6Н4NО2
Сеll-СООАg + НОС6Н4NО2
(1)
еll-СООН
+ АgОС6Н4NО2
Сеll-СООАg + НОС6Н4NО2
(1)
Вычислим содержание НООС- групп в целлюлозном препарате (ХСООН).
1.1 Из уравнения химической реакции (1) следует, что n (Аg) = n (Сеll-СООАg) = n (Сеll-СООН).
n (Аg) = m (Аg)/M (Аg), где
n (Аg) – химическое количество серебра, моль;
m (Аg) – масса серебра, г;
M (Аg) – молярная масса серебра, г/моль;
n (Аg) = 0,0981/107,868 = 90,9 ×10-5 моль.
1.2
XCOOH
=
![]() моль/г, где
моль/г, где
ХСООН – содержание карбоксильных групп, моль/г
n (СООН) – химическое количество НООС- групп, моль;
W – влажность целлюлозы в долях;
g – навеска, г;
n (Сеll-СООН) = n (СООН)
XCOOH
=
![]() моль/г.
моль/г.
Вычислим кислотное число.
Кислотное число (Za ) выражается количеством мг КОН (М = 56 г/моль), которое необходимо для нейтрализации карбоксильных групп в 1 грамме целлюлозного препарата. /6, с.304/
Za
=
![]() ´
56 × 1000 = 10,42.
´
56 × 1000 = 10,42.
Ответ: содержание карбоксильных групп составило моль/г, кислотное число составило 10,42.
Определить ацетильное число (в расчете на связанную уксусную кислоту) и степень замещения ацетилцеллюлозы, если при омылении пробы массой 0,5016 г 0,5 н. щелочью на титрование рабочей пробы было израсходовано 12,95 см3 0,5 н. НСl с f = 1,0025, а на титрование контрольной пробы - 21,51 см3.
Решение.
Схема реакции следующая:
[ С6Н7О2(ОН)3]n
+ nm
СН3COOCOСН3
[С6Н7О2(ОСОСН3)m(OH)3-m]n
+
С6Н7О2(ОН)3]n
+ nm
СН3COOCOСН3
[С6Н7О2(ОСОСН3)m(OH)3-m]n
+
+ nm СН3COOН
В элементарном звене целлюлозы – ангидро-b-D-глюкозе, содержится 3 гидроксильных группы. Поэтому полнота завершенности реакции характеризуется количеством замещенных ОН- групп. Одной из таких характеристик является «степень замещения». Под степенью замещения, m , понимают число замещенных гидроксильных групп в одном элементарном звене. Очевидно, что m может изменяться от 0 до 3. /6, с. 305/
Однако при некоторых реакциях происходит замещение одной гидроксильной группы в расчёте на несколько элементарных звеньев. Поэтому, для удобства пользования, введено понятие «степени этерификации», g – число замещенных ОН-групп, приходящихся на 100 ангидро-b-D-глюкозных остатков. Следовательно, g имеет значения от 0 до 300. /6, с. 305/
Важный показатель свойств ацетилцеллюлозы – ацетильное число (Х CH3COOH). Оно показывает, сколько процентов уксусной кислоты связано в ацетилцеллюлозе. /8/
Рассчитываем содержание связанной уксусной кислоты:
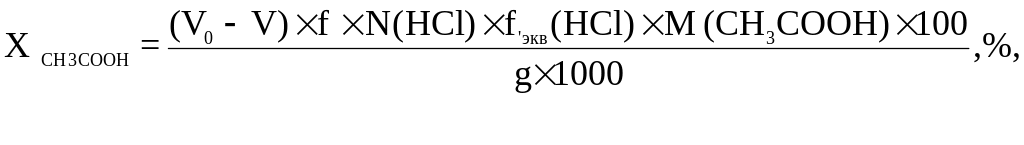
где
V0
и V – количество, см3
0.5 н раствора НСl,
пошедшее на титрование холостой и
исследуемой пробы, соответственно; f –
поправочный коэффициент 0,5 н раствора
НСl;
g – навеска, г; N
(НСl)
– нормальная концентрация (нормальность)
раствора НСl
(N
(НСl)
= С (НСl)
= 0,5 моль/л, т.к. фактор эквивалентности
![]() (НСl)
равен 1, С – молярная концентрация
раствора НСl,
моль/л; М (СН3COOН)
– молярная масса уксусной кислоты
(60,05286 г/моль); 1000 – переводной коэффициент
1 л = 1000 мл.
(НСl)
равен 1, С – молярная концентрация
раствора НСl,
моль/л; М (СН3COOН)
– молярная масса уксусной кислоты
(60,05286 г/моль); 1000 – переводной коэффициент
1 л = 1000 мл.
ХCH3COOH = ((21,51 – 12,95) × 1,0025 × 0,5 × 1 × 60,05286 ×100) / (0,5016 × × 1000) = 51,37 %.
Рассчитаем степень замещения ацетилцеллюлозы:
ХCH3COOH = 60m × 100/(162 + 42m) = 51,37 %,
где m – число замещенных гидроксильных групп в элементарном звене целлюлозы; 60 – молекулярный вес уксусной кислоты; 162 – молекулярный вес элементарного звена целлюлозы; 42 – увеличение молекулярного веса ацетилцеллюлозы при замещении одной гидроксильной группы.
Отсюда, m = 2,17 → g = 217.
Ответ: ацетильное число составило 51,37 %, степень замещения составила 2,17 (g = 217).
