
- •§1. Скорость химической реакции.
- •§2. Закон действующих масс.
- •§3. Факторы, определяющие скорость реакции.
- •3.1 Энергия активации h*.
- •3.2 Температура.
- •3.3 Энтропия активации s*.
- •§4. Параллельные, последовательные и цепные реакции.
- •§5. Элементарная стадия реакции. Молекулярность стадии. Порядок реакции. Механизм реакции.
- •§6 Кинетика реакции разного порядка.
ФФФХИ. 11.10.2013.
Лекция 8.
Скорость и механизм химических реакций (химическая кинетика).
Термодинамика рассматривает лишь возможность осуществления химической реакции, которая выражается условием G ˂ 0. Но скорость прихода системы в состояние равновесия не зависит от G.
Химическая кинетика изучает скорость химических реакций, а также механизм их протекания, то есть реакционный путь, по которому система переходит из начального состояния в конечное.
§1. Скорость химической реакции.
Почему химические процессы протекают с различной скоростью? Для ответа на этот вопрос необходимо дать определение скорости реакции.
Скорость реакции определяется числом элементарных актов химического взаимодействия в единицу времени: для гомогенных реакций – в единице объема, для гетерогенных – на единице поверхности раздела фаз. Под элементарным актом взаимодействия понимается активное столкновение частиц (атомов, молекул, ионов), приводящее к образованию продукта реакции.
При постоянном объеме V
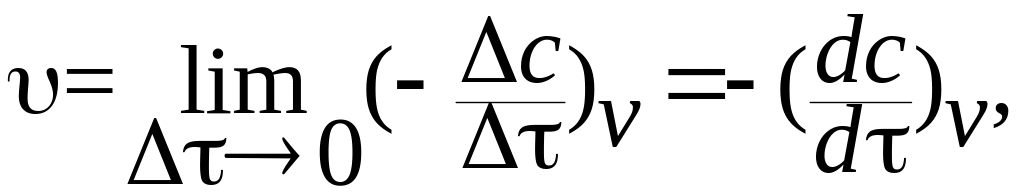
![]() (8.1)
(8.1)
то есть в этом частном случае истинная скорость реакции равна первой производной концентрации исходного вещества по времени, взятой с противоположным знаком.
§2. Закон действующих масс.
Закон действующих масс для скорости реакции, или основной постулат химической кинетики устанавливает зависимость скорости реакции от концентрации реагирующих веществ. Он был открыт норвежскими учеными К. Гульдбергом и П. Вааге в 1864 г. В современной формулировке этот закон утверждает:
Скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, определяемые механизмом данного процесса.
Таким образом, выражение закона действующих масс для прямой реакции синтеза аммиак 3H2+N2→2NH3 можно записать
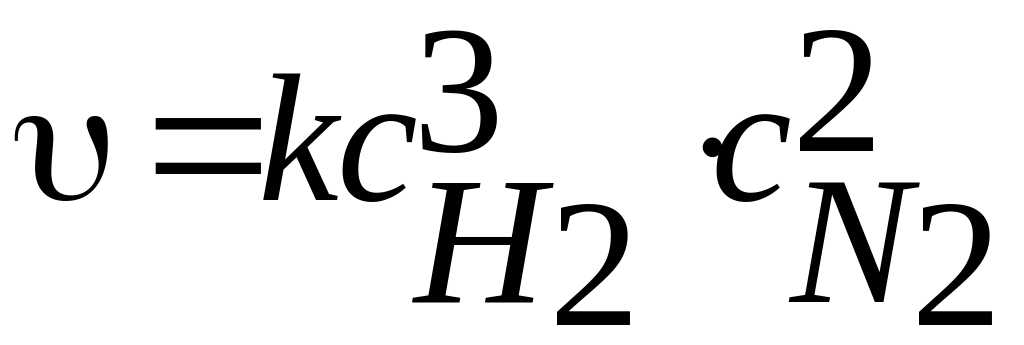 (8.2)
(8.2)
Коэффициент
пропорциональности
![]() представляет собой важнейшую
физико-химическую величину, которая
называется константой
скорости химической реакции
(в данном случае – это константа
скорости прямой реакции).
представляет собой важнейшую
физико-химическую величину, которая
называется константой
скорости химической реакции
(в данном случае – это константа
скорости прямой реакции).
Константа скорости
имеет простой физический смысл. Она
равна скорости данной реакции, когда
концентрации всех реагирующих веществ
равны единице (например, когда
![]() моль/л). Константа скорости зависит от
природы химической реакции (природы
реагентов, продуктов взаимодействия,
природы растворителя) и от температуры.
От концентрации реагирующих веществ
константа скорости не зависит.
моль/л). Константа скорости зависит от
природы химической реакции (природы
реагентов, продуктов взаимодействия,
природы растворителя) и от температуры.
От концентрации реагирующих веществ
константа скорости не зависит.
§3. Факторы, определяющие скорость реакции.
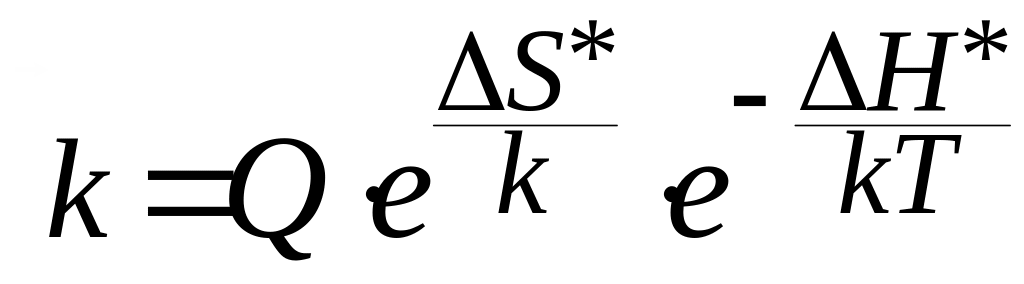 (8.3)
(8.3)
3.1 Энергия активации h*.
Для реакции
Н2 + I2=2HI (8.4)
возможен следующий механизм
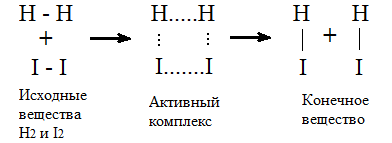
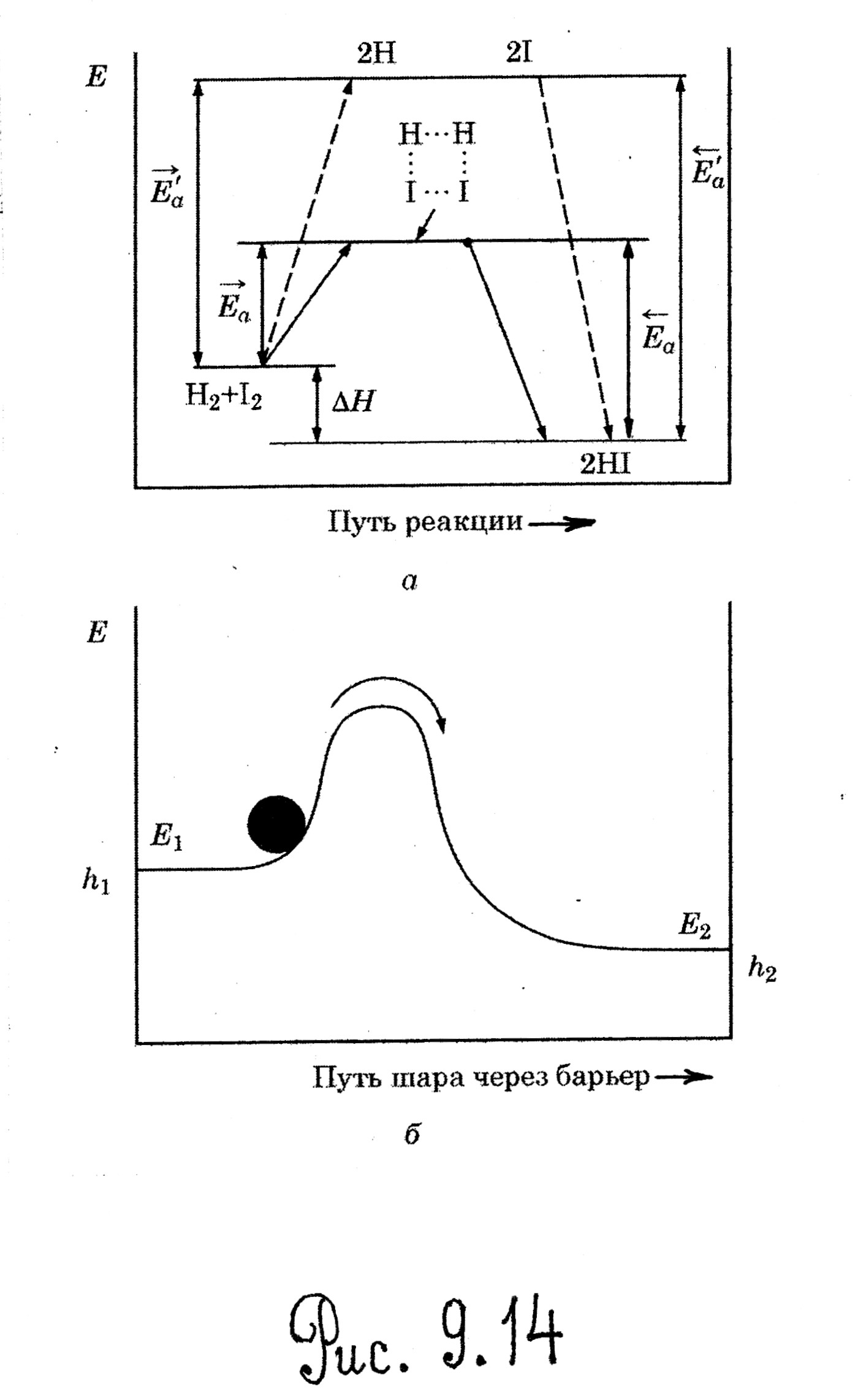
Рисунок 1
Энергетическая диаграмма реакции H2 +I2.
Итак: Энергия активации (H*) – это разница энергий активного комплекса и исходных веществ. Это барьер! Изменить высоту барьера можно с помощью катализатора.
3.2 Температура.
В выражении (8.3)
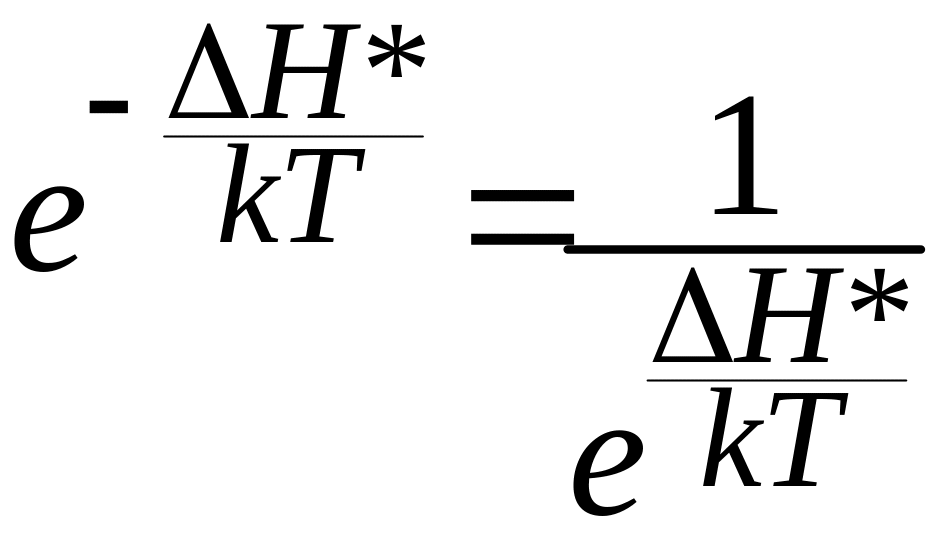 (8.5)
(8.5)
Множитель
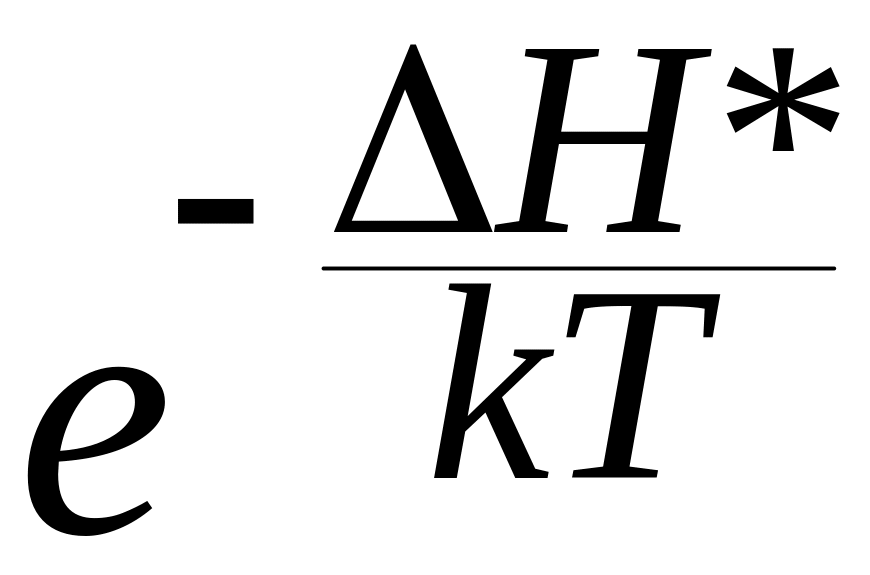 – это доля молекул, обладающих энергией,
достаточной для преодоления барьера.
С ростом Т множитель увеличивается, и,
следовательно, скорость реакции растет.
– это доля молекул, обладающих энергией,
достаточной для преодоления барьера.
С ростом Т множитель увеличивается, и,
следовательно, скорость реакции растет.
3.3 Энтропия активации s*.
а)
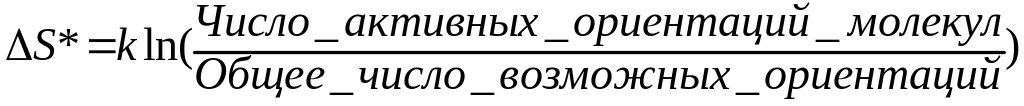
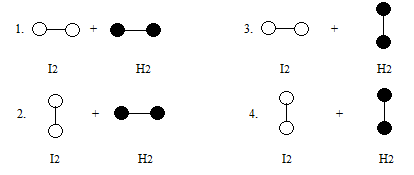
б)
![]() - доля молекул,
обладающих ориентацией, благоприятной
для реакции.
- доля молекул,
обладающих ориентацией, благоприятной
для реакции.
3.4 Q – общее число столкновений.
Q ~ mV2, т.е. зависит от массы молекул
I2+H2=2HI; V1
Br2+H2=2HBr; V2
при Т= const, mV2 (Br) =mV2 (H)
m(Br): m(H) ~ 80
V(Br2):
V(I2)=![]() ~ 9
~ 9
Общие выводы:
Скорость реакции зависит от:
Концентрации
Природы веществ (H*, S*, m)
Температуры
Пространственной ориентации молекул
Катализатора
