
- •Биохимия
- •Содержание
- •1 Введение
- •1.1 Предмет биохимии
- •1.2 Области исследований биохимии.
- •История развития биохимии.
- •1.4 Методы изучения
- •1.5 Значимость биохимии как науки.
- •2. Аминокислоты, их строение и свойства
- •2.1 Элементарный состав белков.
- •2.2 Аминокислотный состав белков
- •2.3 Классификация аминокислот
- •1) Классификация аминокислот по r-группам
- •2) Классификация аминокислот по функциональным группам
- •2.4 Общие химические свойства
- •Электрофильно-нуклеофильные свойства.
- •1 Стадия.
- •2 Стадия
- •3. Строение и свойства белков. Методы их выделения и очистки
- •3.1 Содержание белков в органах и тканях
- •Биологические функции белков
- •Каталитическая (ферментативная) функции
- •3.2.2 Транспортная функция белков
- •Рецепторная функция:
- •3.2.4 Защитная функция
- •Структурная функция
- •Двигательные белки
- •3.3 Классификация белков
- •3.4 Структуры белка
- •Третичная структура белка. Под третичной структурой белка подразумевают пространственную ориентацию полипептидной спирали или способ укладки полипептидной цепи в определенном объеме.
- •3.5 Физико-химические свойства белков
- •Химия нуклеиновых кислот
- •4.1 Методы выделения нуклеиновых кислот.
- •4.2 Химический состав нуклеиновых кислот
- •4.3.Структура нуклеиновых кислот
- •4.4 Первичная структура нуклеиновых кислот
- •4.5 Вторичная структура нуклеиновых кислот
- •4.6 Третичная структура нуклеиновых кислот
- •4.7 Транспортные рнк
- •4.8 Матричная рнк
- •5. Ферменты
- •Характеристика ферментов, их свойств
- •Отличительные признаки ферментативного и химического катализа.
- •5.3 Пространственное строение
- •5.4 Функции коферментов и простетических групп
- •5.4.4 Кофермент ацетилирования (коэнзим а, или просто КоА)
- •5.5 Классификация и номенклатура ферментов
- •5.6 Механизм действия ферментов
- •6. Ферментативная кинетика
- •6.1 Уравнения Михаэлиса-Ментен и Лайнуивера-Бэрка
- •Факторы, определяющие активность ферментов. Зависимость скорости реакции от времени
- •6.3 Влияние концентраций субстрата и фермента на скорость ферментативной реакции
- •6.4 Активирование и ингибирование ферментов
- •6.5 Применение ферментов
- •7 Химия липидов
- •7.1 Биологическая роль и классификация липидов
- •7.2 Жирные кислоты
- •7.3 Глицериды (ацилглицеролы)
- •7.4 Фосфолипиды
- •7.5 Сфинголипиды (сфингофосфолипиды)
- •7.6 Стероиды
- •Химия углеводов
- •8.1 Биологическая роль углеводов
- •Классификация углеводов
- •Моносахариды
- •Основные реакции моносахаридов, продукты реакций и их свойства.
- •Олигосахариды
- •8.6 Полисахариды
- •8.7 Гетерополисахариды
- •9 Витамины
- •9.1 Классификация витаминов
- •9.2 Витамины, растворимые в жирах.
- •9.2.1 Витамины группы а
- •9.2.2 Витамины группы d
- •9.2.3 Витамины группы к
- •9.2.4 Витамины группы е
- •9.3 Витамины, растворимые в воде
- •9.3.1 Витамин b1
- •9.3.2 Витамин в2
- •9.3.3 Витамин рр
- •9.3.4 Витамин в6
- •9.3.5 Биотин (витамин н)
- •9.3.6 Фолиевая кислота
- •9.3.7 Витамин в12
- •9.3.8 Пантотеновая кислота (витамин в3)
- •9.3.8 Витамин с
- •9.3.9 Витамин р
- •10. Гормоны
- •10.1 Общее понятие о гормонах
- •10.2 Номенклатура и классификация гормонов
- •10.3 Гормоны гипоталамуса
- •10.3 Гормоны гипофиза
- •10.4 Вазопрессин и окситоцин
- •10.5 Меланоцитстимулирующие гормоны (мсг, меланотропины)
- •10.6 Адренокортикотропный гормон (актг, кортикотропин)
- •10.7 Соматотропный гормон (стг, гормон роста, соматотропин)
- •10.8 Лактотропный гормон (пролактин, лютеотропный гормон)
- •10.9 Тиреотропный гормон (ттг, тиротропин)
- •10.10 Гонадотропные гормоны (гонадотропины)
- •10.11 Липотропные гормоны (лтг, липотропины)
- •10.12 Гормоны паращитовидных желез (паратгормоны)
- •10.13 Гормоны щитовидной железы
- •10.15 Гормоны поджелудочной железы
- •10.16 Гормоны надпочечников
- •10.17 Половые гормоны
- •10.18 Гормоны вилочковой железы (тимуса)
- •10.19 Молекулярные механизмы передачи гормонального сигнала
- •Аденилатциклазная мессенджерная система. Наиболее изученным является аденилатциклазный путь передачи гормонального сигнала. В нем задействовано минимум пять хорошо изученных белков:
- •11. Обмен веществ и энергии
- •11.1 Понятие метаболизма.
- •11.2 Биологическое окисление
- •11.3 Атф (аденозинтрифосфорная кислота)
- •12. Обмен углеводов
- •12.1 Переваривание и всасывание
- •12.2 Промежуточный обмен
- •12.2.1 Общая характеристика
- •2 Молекулы пвк (2 молекулы по 3 атома углерода)
- •12.2.2 Анаэробный распад
- •I этап 1. Фосфорилирование (активация) глюкозы:
- •7. Гидролиз 3 фосфоглицероилфосфата
- •8. Изомеризация 3-фосфоглицерата
- •III этап 9. Дегидратация 2-фосфоглицерата
- •12.2.3 Аэробный распад
- •13 Синтез углеводов
- •13.1 Строение и синтез гликогена
- •13.2 Регуляция синтеза и его нарушения
- •Глюконеогенез
- •1 ,3 Дифосфоглицерат
- •14 Обмен липидов
- •14. 1 Метаболизм триглицеридов
- •14.2 Промежуточный обмен
- •14.2.1 Превращение триглицеридов и окисление глицерина.
- •14.2.2 Окисление жирных кислот
- •14.2.3 Биосинтез жирных кислот
- •14.2.3 Превращения глицерофосфатидов
- •Обмен белков
- •15.1 Значение белков в организме
- •15.2 Переваривание и всасывание белка
- •Промежуточный обмен
- •Биосинтез белка
- •Дезаминирование аминокислот
- •Переаминирование (трансаминирование) аминокислот
- •Декарбоксилирование аминокислот
- •16 Обмен сложных белков
- •16.1 Обмен нуклеопротеидов
- •17.2 Обмен гемоглобина
- •17 Обмен белков. Цикл мочевины
- •17. 1 Конечные продукты распада аминокислот
- •17. 2 Синтез мочевины, орнитиновый цикл
- •17.3 Обмен отдельных аминокислот
- •18 Взаимосвязь обмена белков, жиров и углеводов. Обмен воды и минеральных солей.
- •18.1 Взаимосвязь обмена углеводов и жиров.
- •18.2 Взаимосвязь обмена углеводов и белков.
- •18.3 Взаимосвязь обмена белков и жиров.
- •18.4 Понятие о гомеостазе.
- •18.5 Водный обмен и его регуляция.
- •18.6 Минеральный обмен
17. 2 Синтез мочевины, орнитиновый цикл
Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Последняя выводится с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного, обмена. На долю мочевины приходится до 80–85% от всего азота мочи. Основным и, возможно, единственным местом синтеза мочевины является печень. Впервые Г. Кребс и К. Гензеляйт в 1932 г. вывели уравнения реакций синтеза мочевины, которые представлены в виде цикла, получившего в литературе название орнитинового цикла мочевинообразования Кребса. Следует указать, что в биохимии это была первая циклическая система метаболизма, описание которой почти на 5 лет опеределило открытие Г. Кребсом другого метаболического процесса – цикла трикарбоновых кислот. Дальнейшие исследования в основном подтвердили циклический характер биосинтеза мочевины в печени. Благодаря исследованиям Г. Коена, С. Ратнер и сотр. были уточнены промежуточные этапы и ферментные системы, катализирующие образование мочевины.
Таким образом, весь цикл мочевинообразования может быть представлен следующим образом. На первом этапе синтезируется макроэргическое соединение карбамоилфосфат – метаболически активная форма аммиака, используемая в качестве исходного продукта для синтеза пиримидиновых нуклеотидов (соответственно ДНК и РНК) и аргинина (соответственно белка и мочевины):
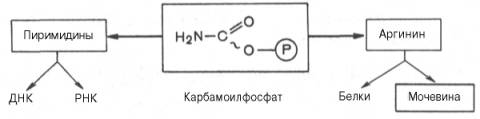
Мочевина – основной конечный продукт азотистого обмена, в составе которого из организма выводится избыток азота. Орнитиновый цикл в печени выполняет две функции:
- превращение аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака;
- синтез аргинина и пополнение его фонда в организме.
Рассмотрим цикл мочевины:
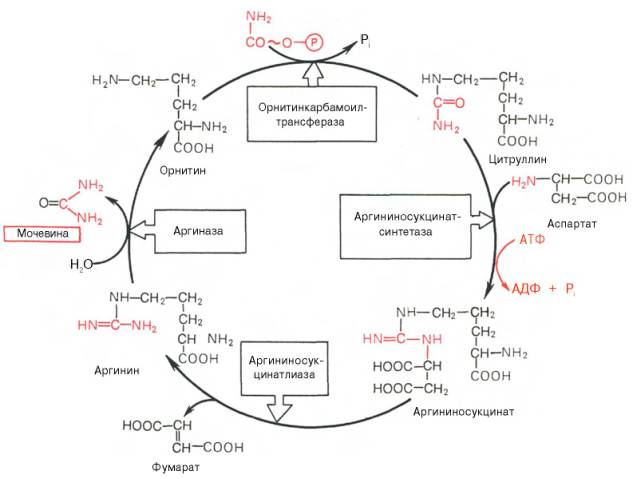
Рис. 33 Орнитиновый цикл синтеза мочевины в печени.
Начинается он с образования карбамоилфосфата в митохондриях, где много АТФ.
1. О б р а з о в а н и е к а р б а м о и л ф о с ф а т а. Ионы аммония, возникшие в результате окислительного дезаминирования глутаминовой кислоты, взаимодействуют с гидрокарбонат - анионом и АТФ при участии карбамоилфосфатсинтетазы, образуя карбамоилфосфат, содержащий макроэргическую связь:
О
//
NН4+ + НСО3- + 2АТФ → Н2N – С + 2АДФ + Н2РО4- + Н+
\
О ~ Ф
Карбамоилфосфат
2. П о л у ч е н и е ц и т р у л л и н а. В матриксе митохондрий карбамоилфосфат конденсируется с аминокислотой орнитином, которая, являясь гомологом лизина, не входит в состав белков. Реакция катализируется орнитинкарбамоилтрансферазой:
Н СОО- О Н СОО-
\ / // \ /
С + Н2N – С → С О + Н2РО4-
+ / \ + \ + / \ ||
Н3N (СН2)3NН3 О ~ Ф Н3N (СН2)3NН – С – NН2
Орнитин Карбамоилфосфат цитруллин
Образующийся цитруллин переходит в цитозоль клеток печени, где и происходят остальные реакции цикла мочевины.
3. По л у ч е н и е а р г и н и н о с у к ц и н а т а . Замещение карбонильной группы цитруллина на аминогруппу аспартата с образованием гуанидиновой группировки аргининосукцината происходит при участии АТФ и катализируется аргининосукцинатсинтетазой:
Н СОО- Н СОО-
\ / \ /
С О + С + АТФ →
+ / \ || / \
Н3N (СН2)3NН – С – NН2 Н3N СН2СОО-
Цитруллин аспартат
Н СОО-
\ / +
С Н2N СН2СОО- + Н2Р2О72- + АМФ
+ / \ || |
Н3N (СН2)3NН – С – NН – СНСОО-
Аргининосукцинат
Реакция эндэргоническая, на протекание первой и третьей реакций цикла расходуется 4 молекулы АТФ.
4. Ра с п а д а р г и н и н о с у к ц и н а т а. Под действием аргининосукцинатлиазы аргининосукцинат экзэргонически расщепляется с образованием аргинина и фумарата:
Н СОО- Н СОО- СОО- Н
\ / + \ / + \ /
С Н2N СН2СОО- → С Н2N + С = С
+ / \ || | + / \ || / \
Н3N (СН2)3NН – С – NН – СНСОО- Н3N (СН2)3NН – С – NН2 Н СОО-
Аргининосукцинат Аргинин Фумарат
5. О б р а з о в а н и е м о ч е в и н ы и р е г е н е р а ц и я о р н и т и н а. Гидролиз аргинина, катализируемый аргиназой, приводит к образованию мочевины и регенерации орнитина. Реакция экзэргонична.
Н СОО- Н СОО- NН2
\ / + + \ / /
С Н2N → С + О = С
+ / \ || + / \ + \
Н3N (СН2)3NН – С – NН2 Н3N (СН2)3NН3 NН2
Аргинин Орнитин Мочевина
Регенерированный орнитин может снова поступать в митохондрии и участвовать в новом обороте цикла мочевины. Образующуюся мочевину кровь переносит из печени в почки, где извлекается из крови и удаляется из организма с мочой.
В орнитиновом цикле расходуется 4 макроэргические связи трех молекул АТФ на каждый оборот цикла. Однако процесс образования мочевины обеспечивает сам себя энергией:
- при регенерации аспартата из фумарата на стадии дегидрирования малата образуется НАДН, который может обеспечить синтез 3 макроэргических связей.
- при окислительном дезаминировании глутамата в разных органах тоже образуется НАДН, который может обеспечить синтез 3 макроэргических связей.
Из приведенных реакций видно, что токсичный аммиак превращается в безвредную мочевину. При этом один из атомов азота мочевины образуется из аммиака, другой – из аспартата.
