
- •Биохимия
- •Содержание
- •1 Введение
- •1.1 Предмет биохимии
- •1.2 Области исследований биохимии.
- •История развития биохимии.
- •1.4 Методы изучения
- •1.5 Значимость биохимии как науки.
- •2. Аминокислоты, их строение и свойства
- •2.1 Элементарный состав белков.
- •2.2 Аминокислотный состав белков
- •2.3 Классификация аминокислот
- •1) Классификация аминокислот по r-группам
- •2) Классификация аминокислот по функциональным группам
- •2.4 Общие химические свойства
- •Электрофильно-нуклеофильные свойства.
- •1 Стадия.
- •2 Стадия
- •3. Строение и свойства белков. Методы их выделения и очистки
- •3.1 Содержание белков в органах и тканях
- •Биологические функции белков
- •Каталитическая (ферментативная) функции
- •3.2.2 Транспортная функция белков
- •Рецепторная функция:
- •3.2.4 Защитная функция
- •Структурная функция
- •Двигательные белки
- •3.3 Классификация белков
- •3.4 Структуры белка
- •Третичная структура белка. Под третичной структурой белка подразумевают пространственную ориентацию полипептидной спирали или способ укладки полипептидной цепи в определенном объеме.
- •3.5 Физико-химические свойства белков
- •Химия нуклеиновых кислот
- •4.1 Методы выделения нуклеиновых кислот.
- •4.2 Химический состав нуклеиновых кислот
- •4.3.Структура нуклеиновых кислот
- •4.4 Первичная структура нуклеиновых кислот
- •4.5 Вторичная структура нуклеиновых кислот
- •4.6 Третичная структура нуклеиновых кислот
- •4.7 Транспортные рнк
- •4.8 Матричная рнк
- •5. Ферменты
- •Характеристика ферментов, их свойств
- •Отличительные признаки ферментативного и химического катализа.
- •5.3 Пространственное строение
- •5.4 Функции коферментов и простетических групп
- •5.4.4 Кофермент ацетилирования (коэнзим а, или просто КоА)
- •5.5 Классификация и номенклатура ферментов
- •5.6 Механизм действия ферментов
- •6. Ферментативная кинетика
- •6.1 Уравнения Михаэлиса-Ментен и Лайнуивера-Бэрка
- •Факторы, определяющие активность ферментов. Зависимость скорости реакции от времени
- •6.3 Влияние концентраций субстрата и фермента на скорость ферментативной реакции
- •6.4 Активирование и ингибирование ферментов
- •6.5 Применение ферментов
- •7 Химия липидов
- •7.1 Биологическая роль и классификация липидов
- •7.2 Жирные кислоты
- •7.3 Глицериды (ацилглицеролы)
- •7.4 Фосфолипиды
- •7.5 Сфинголипиды (сфингофосфолипиды)
- •7.6 Стероиды
- •Химия углеводов
- •8.1 Биологическая роль углеводов
- •Классификация углеводов
- •Моносахариды
- •Основные реакции моносахаридов, продукты реакций и их свойства.
- •Олигосахариды
- •8.6 Полисахариды
- •8.7 Гетерополисахариды
- •9 Витамины
- •9.1 Классификация витаминов
- •9.2 Витамины, растворимые в жирах.
- •9.2.1 Витамины группы а
- •9.2.2 Витамины группы d
- •9.2.3 Витамины группы к
- •9.2.4 Витамины группы е
- •9.3 Витамины, растворимые в воде
- •9.3.1 Витамин b1
- •9.3.2 Витамин в2
- •9.3.3 Витамин рр
- •9.3.4 Витамин в6
- •9.3.5 Биотин (витамин н)
- •9.3.6 Фолиевая кислота
- •9.3.7 Витамин в12
- •9.3.8 Пантотеновая кислота (витамин в3)
- •9.3.8 Витамин с
- •9.3.9 Витамин р
- •10. Гормоны
- •10.1 Общее понятие о гормонах
- •10.2 Номенклатура и классификация гормонов
- •10.3 Гормоны гипоталамуса
- •10.3 Гормоны гипофиза
- •10.4 Вазопрессин и окситоцин
- •10.5 Меланоцитстимулирующие гормоны (мсг, меланотропины)
- •10.6 Адренокортикотропный гормон (актг, кортикотропин)
- •10.7 Соматотропный гормон (стг, гормон роста, соматотропин)
- •10.8 Лактотропный гормон (пролактин, лютеотропный гормон)
- •10.9 Тиреотропный гормон (ттг, тиротропин)
- •10.10 Гонадотропные гормоны (гонадотропины)
- •10.11 Липотропные гормоны (лтг, липотропины)
- •10.12 Гормоны паращитовидных желез (паратгормоны)
- •10.13 Гормоны щитовидной железы
- •10.15 Гормоны поджелудочной железы
- •10.16 Гормоны надпочечников
- •10.17 Половые гормоны
- •10.18 Гормоны вилочковой железы (тимуса)
- •10.19 Молекулярные механизмы передачи гормонального сигнала
- •Аденилатциклазная мессенджерная система. Наиболее изученным является аденилатциклазный путь передачи гормонального сигнала. В нем задействовано минимум пять хорошо изученных белков:
- •11. Обмен веществ и энергии
- •11.1 Понятие метаболизма.
- •11.2 Биологическое окисление
- •11.3 Атф (аденозинтрифосфорная кислота)
- •12. Обмен углеводов
- •12.1 Переваривание и всасывание
- •12.2 Промежуточный обмен
- •12.2.1 Общая характеристика
- •2 Молекулы пвк (2 молекулы по 3 атома углерода)
- •12.2.2 Анаэробный распад
- •I этап 1. Фосфорилирование (активация) глюкозы:
- •7. Гидролиз 3 фосфоглицероилфосфата
- •8. Изомеризация 3-фосфоглицерата
- •III этап 9. Дегидратация 2-фосфоглицерата
- •12.2.3 Аэробный распад
- •13 Синтез углеводов
- •13.1 Строение и синтез гликогена
- •13.2 Регуляция синтеза и его нарушения
- •Глюконеогенез
- •1 ,3 Дифосфоглицерат
- •14 Обмен липидов
- •14. 1 Метаболизм триглицеридов
- •14.2 Промежуточный обмен
- •14.2.1 Превращение триглицеридов и окисление глицерина.
- •14.2.2 Окисление жирных кислот
- •14.2.3 Биосинтез жирных кислот
- •14.2.3 Превращения глицерофосфатидов
- •Обмен белков
- •15.1 Значение белков в организме
- •15.2 Переваривание и всасывание белка
- •Промежуточный обмен
- •Биосинтез белка
- •Дезаминирование аминокислот
- •Переаминирование (трансаминирование) аминокислот
- •Декарбоксилирование аминокислот
- •16 Обмен сложных белков
- •16.1 Обмен нуклеопротеидов
- •17.2 Обмен гемоглобина
- •17 Обмен белков. Цикл мочевины
- •17. 1 Конечные продукты распада аминокислот
- •17. 2 Синтез мочевины, орнитиновый цикл
- •17.3 Обмен отдельных аминокислот
- •18 Взаимосвязь обмена белков, жиров и углеводов. Обмен воды и минеральных солей.
- •18.1 Взаимосвязь обмена углеводов и жиров.
- •18.2 Взаимосвязь обмена углеводов и белков.
- •18.3 Взаимосвязь обмена белков и жиров.
- •18.4 Понятие о гомеостазе.
- •18.5 Водный обмен и его регуляция.
- •18.6 Минеральный обмен
Электрофильно-нуклеофильные свойства.
1) Реакция ацилирование – взаимодействие со спиртами:
NаОН
NH3+– CRH – COO- + СН3ОН + НС1 → Н2О + [NH3+– CRH – COOСН3]С1 →
→ NH2–CRH – COOСН3 + NаСl + Н2О
Метиловый эфир аминокислоты.
В организме аспарагиновая и глутаминовая кислоты под действием соответствующих ферментов и АТФ легко ацилируют аммиак с образованием аспарагина и глутамина соответственно:
аспарагинсинтетеза
 NH3+–
CH – COO-
+
NH3
NH3+–
CH – COO-
+
Н2О
NH3+–
CH – COO-
+
NH3
NH3+–
CH – COO-
+
Н2О
| АТФ |
СН2СООН СН2СОNH2
Аспарагиновая кислота аспарагин
При взаимодействии двух аминокислот со свободной аминогруппой и с активированной карбоксильной группой образуются дипептиды:
О Н
|| |
NH3+– CRH – COO- + NH2 –CRH – COOН → NH3+– CRH – C – N– CRH – COOН
2) Реакции алкилирования
СН3I СН3I

 NH2
–
CRH – COOН
СН3NН
– CRH – COOН
NH2
–
CRH – COOН
СН3NН
– CRH – COOН
NаОН NаОН
СН3I
 (СН3)2
N– CRH – COOН
(СН3)3
N+
–
CRH – COO-
(СН3)2
N– CRH – COOН
(СН3)3
N+
–
CRH – COO-
NаОН Беатин аминокислоты
Окислительно-восстановительные свойства. Тиол-дисульфидное равновесие. Цистеин как все тиолы, выступая восстановителем, легко окисляется, образуя цистин, являющийся дисульфидом цистеина.
NH3+– CH – COO- -2е,- 2Н+ S – СН2 – СН(NH3+)COO-
2
 |
|
|
|
СН2 –SН +2е,+ 2Н+ S – СН2– СН(NH3+)COO-
Цистеин (восстановитель) Цистин (сопряженный окислитель)
При радиационном воздействии в водных средах организма возникают сильные окислители ·ОН, ·НО2, Н2О2 , ·О2, а также и другие токсиканты – короткоживущие сильные восстановители: гидратированный электрон, и атомарный водород. Сопряженный окислитель-восстановитель цистеин-цистин активно взаимодействует и с теми и с другими, нейтрализуя их.
При полном окислении цистеина образуется цистеиновая кислота, которая потом в результате реакции декарбоксилирования образует таурин. Таурин, взаимодействуя с холевой кислотой, образует таурохолевую кислоту, которая участвует в дальнейшем в эмульгировании жиров.
NH3+–CH – COO- [О] NH3+– CH – COO- (- СО2)

 |
|
NH3+–
СН2–
СН2
–SН
|
|
NH3+–
СН2–
СН2
–SН
СН2SО3- СН2 –SО3-
Цистеин цистеиновая кислота таурин
Декарбоксилирование. В лабораторных условиях протекает при участии Ва(ОН)2
+NH3– C0RH – C+3OO- + Ва(ОН)2 → NH2–C-1H2R + ВаС+4О3 + Н2О

Окис-ль Вос-ль
При декарбоксилировании α-аминокислот в организме синтезируются биогенные амины, выполняющие важные биологические функции:
Таблица 2. Биогенные амины
Исходная аминокислота |
Биогенный амин |
Формула амина |
Серин |
2-аминоэтанол (коламин) |
NH2CH2CН2OН |
Цистеин |
2-аминоэтантиол |
NH2CH2CН2SН |
Лизин |
Пентаметилендиамин |
NH2 (CH2)5NН2 |
Аспарагиновая кислота |
Β-Аланин |
NH3+CH2СН2– COO- |
Глутаминовая кислота |
Γ-Аминомасляная кислота |
NH2CH2CH2CН2COOН |
Гистидин |
Гистамин |
N
NН |
Триптофан |
Триптамин |
N
N |
Прямое дезаминирование. Этот процесс характерен для аминокислот у которых в β-положении содержится гидроксильная или тиольная группа.
 Вос-ль
СОО-
Вос-ль
СОО-
NH3+- C0H – COO- пиридоксальфосфат /


 |
С-2Н2
=
С+1
|
С-2Н2
=
С+1
 С-1Н2
–SН
-
Н2S
\
С-1Н2
–SН
-
Н2S
\
вос-ль ок-ль N+H3
Ок -ль Цистин енаминокислота
СОО-
/ Н2О
С -3Н3 – С+2 СН3 – С – СООН
\\ - NН3 ||
N+Н2 О
α-иминокислота пировиноградная кислота
Трансаминирование. Этот процесс в организме протекает при участии кофермента пиридоксальфосфата и соответствующей трансаминазы. Кофермент пиридоксальфосфат играет роль переносчика аминогруппы.
R - C0H – COO- + R' – C+2 – COOН пиридоксальфосфат


 |
||
трансаминаза
|
||
трансаминаза
Вос-ль NH3+ ок-ль О

 R
– C+2
– COOН
+ R' - C0H
– COO-
R
– C+2
– COOН
+ R' - C0H
– COO-
|| |
О +NH3
Окислительное дезаминирование. а) Взаимодействие с азотистой кислотой. Используется для количественного определения аминных групп в аминокислоте., а также в белках и продуктах распада.

 N+3H3–
RCH
– COO-
+ НN+3О2
НО
– RCH
– COOН
+ N20
+ Н2О
N+3H3–
RCH
– COO-
+ НN+3О2
НО
– RCH
– COOН
+ N20
+ Н2О
Вос-ль Ок-ль
б) Частичное взаимодействие аргинина молекулой кислорода, в результате которого образуется цитруллин, один из продуктов цикла мочевины.
NH2– CH – COO-
| NО-синтетаза
2 (CH2)3NH – C – NH2 + НАДФ(Н) + 3О2 + Н+
||
NH2+
Н СОО-
\ /
С О + НАДФ+ + 2 NО + 2 Н2О
+ / \ ||
Н3N (СН2)3NН – С – NН2
цитруллин
Образующийся оксид азота (II) быстро используется в иммунной системе для устранения ксенобиотиков, а также для регуляции кровяного давления за счет расслабления мышц кровеносных сосудов.
Взаимодействие с нингидрином. Общая качественная реакция α-аминокислот заключается во взаимодействии с нингидрином в водных растворах при нагревании и появлением сине-фиолетовой окраски, интенсивность которой зависит от концентрации α-аминокислот.
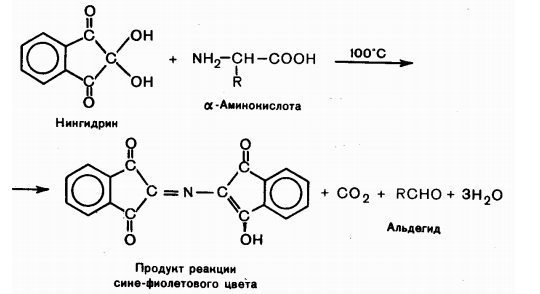
Взаимодействие с дегидрогеназой. В организме аланин, аспарагиновая и глутаминовая кислота подвергаются окислительному дезаминированию под действием соответствующих дегидрогеназ с коферментом НАД+ или НАДФ+.

 H2CH2СН2
H2CH2СН2

 H2
CH2СН2
N
H2
CH2СН2
N
