
- •Биохимия
- •Содержание
- •1 Введение
- •1.1 Предмет биохимии
- •1.2 Области исследований биохимии.
- •История развития биохимии.
- •1.4 Методы изучения
- •1.5 Значимость биохимии как науки.
- •2. Аминокислоты, их строение и свойства
- •2.1 Элементарный состав белков.
- •2.2 Аминокислотный состав белков
- •2.3 Классификация аминокислот
- •1) Классификация аминокислот по r-группам
- •2) Классификация аминокислот по функциональным группам
- •2.4 Общие химические свойства
- •Электрофильно-нуклеофильные свойства.
- •1 Стадия.
- •2 Стадия
- •3. Строение и свойства белков. Методы их выделения и очистки
- •3.1 Содержание белков в органах и тканях
- •Биологические функции белков
- •Каталитическая (ферментативная) функции
- •3.2.2 Транспортная функция белков
- •Рецепторная функция:
- •3.2.4 Защитная функция
- •Структурная функция
- •Двигательные белки
- •3.3 Классификация белков
- •3.4 Структуры белка
- •Третичная структура белка. Под третичной структурой белка подразумевают пространственную ориентацию полипептидной спирали или способ укладки полипептидной цепи в определенном объеме.
- •3.5 Физико-химические свойства белков
- •Химия нуклеиновых кислот
- •4.1 Методы выделения нуклеиновых кислот.
- •4.2 Химический состав нуклеиновых кислот
- •4.3.Структура нуклеиновых кислот
- •4.4 Первичная структура нуклеиновых кислот
- •4.5 Вторичная структура нуклеиновых кислот
- •4.6 Третичная структура нуклеиновых кислот
- •4.7 Транспортные рнк
- •4.8 Матричная рнк
- •5. Ферменты
- •Характеристика ферментов, их свойств
- •Отличительные признаки ферментативного и химического катализа.
- •5.3 Пространственное строение
- •5.4 Функции коферментов и простетических групп
- •5.4.4 Кофермент ацетилирования (коэнзим а, или просто КоА)
- •5.5 Классификация и номенклатура ферментов
- •5.6 Механизм действия ферментов
- •6. Ферментативная кинетика
- •6.1 Уравнения Михаэлиса-Ментен и Лайнуивера-Бэрка
- •Факторы, определяющие активность ферментов. Зависимость скорости реакции от времени
- •6.3 Влияние концентраций субстрата и фермента на скорость ферментативной реакции
- •6.4 Активирование и ингибирование ферментов
- •6.5 Применение ферментов
- •7 Химия липидов
- •7.1 Биологическая роль и классификация липидов
- •7.2 Жирные кислоты
- •7.3 Глицериды (ацилглицеролы)
- •7.4 Фосфолипиды
- •7.5 Сфинголипиды (сфингофосфолипиды)
- •7.6 Стероиды
- •Химия углеводов
- •8.1 Биологическая роль углеводов
- •Классификация углеводов
- •Моносахариды
- •Основные реакции моносахаридов, продукты реакций и их свойства.
- •Олигосахариды
- •8.6 Полисахариды
- •8.7 Гетерополисахариды
- •9 Витамины
- •9.1 Классификация витаминов
- •9.2 Витамины, растворимые в жирах.
- •9.2.1 Витамины группы а
- •9.2.2 Витамины группы d
- •9.2.3 Витамины группы к
- •9.2.4 Витамины группы е
- •9.3 Витамины, растворимые в воде
- •9.3.1 Витамин b1
- •9.3.2 Витамин в2
- •9.3.3 Витамин рр
- •9.3.4 Витамин в6
- •9.3.5 Биотин (витамин н)
- •9.3.6 Фолиевая кислота
- •9.3.7 Витамин в12
- •9.3.8 Пантотеновая кислота (витамин в3)
- •9.3.8 Витамин с
- •9.3.9 Витамин р
- •10. Гормоны
- •10.1 Общее понятие о гормонах
- •10.2 Номенклатура и классификация гормонов
- •10.3 Гормоны гипоталамуса
- •10.3 Гормоны гипофиза
- •10.4 Вазопрессин и окситоцин
- •10.5 Меланоцитстимулирующие гормоны (мсг, меланотропины)
- •10.6 Адренокортикотропный гормон (актг, кортикотропин)
- •10.7 Соматотропный гормон (стг, гормон роста, соматотропин)
- •10.8 Лактотропный гормон (пролактин, лютеотропный гормон)
- •10.9 Тиреотропный гормон (ттг, тиротропин)
- •10.10 Гонадотропные гормоны (гонадотропины)
- •10.11 Липотропные гормоны (лтг, липотропины)
- •10.12 Гормоны паращитовидных желез (паратгормоны)
- •10.13 Гормоны щитовидной железы
- •10.15 Гормоны поджелудочной железы
- •10.16 Гормоны надпочечников
- •10.17 Половые гормоны
- •10.18 Гормоны вилочковой железы (тимуса)
- •10.19 Молекулярные механизмы передачи гормонального сигнала
- •Аденилатциклазная мессенджерная система. Наиболее изученным является аденилатциклазный путь передачи гормонального сигнала. В нем задействовано минимум пять хорошо изученных белков:
- •11. Обмен веществ и энергии
- •11.1 Понятие метаболизма.
- •11.2 Биологическое окисление
- •11.3 Атф (аденозинтрифосфорная кислота)
- •12. Обмен углеводов
- •12.1 Переваривание и всасывание
- •12.2 Промежуточный обмен
- •12.2.1 Общая характеристика
- •2 Молекулы пвк (2 молекулы по 3 атома углерода)
- •12.2.2 Анаэробный распад
- •I этап 1. Фосфорилирование (активация) глюкозы:
- •7. Гидролиз 3 фосфоглицероилфосфата
- •8. Изомеризация 3-фосфоглицерата
- •III этап 9. Дегидратация 2-фосфоглицерата
- •12.2.3 Аэробный распад
- •13 Синтез углеводов
- •13.1 Строение и синтез гликогена
- •13.2 Регуляция синтеза и его нарушения
- •Глюконеогенез
- •1 ,3 Дифосфоглицерат
- •14 Обмен липидов
- •14. 1 Метаболизм триглицеридов
- •14.2 Промежуточный обмен
- •14.2.1 Превращение триглицеридов и окисление глицерина.
- •14.2.2 Окисление жирных кислот
- •14.2.3 Биосинтез жирных кислот
- •14.2.3 Превращения глицерофосфатидов
- •Обмен белков
- •15.1 Значение белков в организме
- •15.2 Переваривание и всасывание белка
- •Промежуточный обмен
- •Биосинтез белка
- •Дезаминирование аминокислот
- •Переаминирование (трансаминирование) аминокислот
- •Декарбоксилирование аминокислот
- •16 Обмен сложных белков
- •16.1 Обмен нуклеопротеидов
- •17.2 Обмен гемоглобина
- •17 Обмен белков. Цикл мочевины
- •17. 1 Конечные продукты распада аминокислот
- •17. 2 Синтез мочевины, орнитиновый цикл
- •17.3 Обмен отдельных аминокислот
- •18 Взаимосвязь обмена белков, жиров и углеводов. Обмен воды и минеральных солей.
- •18.1 Взаимосвязь обмена углеводов и жиров.
- •18.2 Взаимосвязь обмена углеводов и белков.
- •18.3 Взаимосвязь обмена белков и жиров.
- •18.4 Понятие о гомеостазе.
- •18.5 Водный обмен и его регуляция.
- •18.6 Минеральный обмен
9.2.3 Витамины группы к
К витаминам группы К, согласно номенклатуре биологической химии, относятся 2 типа хинонов с боковыми цепями, представленными изопреноидными звеньями (цепями): витамины К1 и К2 . В основе циклической структуры обоих витаминов лежит кольцо 1,4-нафтохинона. Заметим, что животные ткани наделены способностью синтеза боковых изопреновых цепей, но не могут синтезировать нафтохиноновый компонент. У большинства бактерий витамин К является компонентом дыхательной цепи вместо убихинона.
Для витамина К1 сохранено название «филлохинон», а для витаминов группы К2 введено название «менахинон» с указанием числа изопреновых звеньев . В частности, для витамина К2 рекомендовано название «менахинон-6», где цифра 6 указывает число изопреновых звеньев в боковой цепи.
Витамин K1 (филлохинон) впервые был изолирован из люцерны. Это производное 2-метил-1,4-нафтохинона, содержащего в 3-м положении фитильный радикал, имеющий 20 атомов углерода:
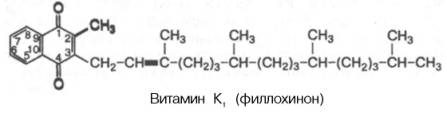
Витамин К2 открыт в растениях и в организме животных и содержит в боковой цепи от 6 до 9 изопреновых единиц.
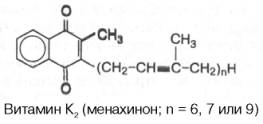
Витамин K1 представляет собой светло-желтую жидкость, неустойчивую при нагревании в щелочной среде и при облучении, а витамин К2 – желтые кристаллы; он также неустойчив. Оба препарата нерастворимы в воде, но хорошо растворимы в органических растворителях: бензоле, хлороформе, ацетоне, гексане и др.
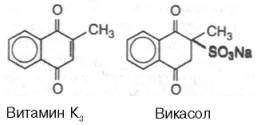
Помимо витаминов K1 и К2, некоторые производные нафтохинона обладают витаминными свойствами и высокой антигеморрагической активностью. Так, синтетический аналог витамина К, лишенный боковой цепи в положении 3, называют витамином К3 (менадион, или 2-метил-1,4-нафто-хинон); фактически он является провитамином. Поскольку витамин К3 нерастворим в воде, на его основе были синтезированы десятки растворимых в воде производных, одно из которых нашло широкое применение в медицинской практике – это синтезированная А.В. Палладиным натриевая соль бисульфитного производного витамина К3 – викасол:
Витамин К является антигеморрагическим фактором, определенным образом связанным со свертыванием крови: он существенно удлиняет его период. Поэтому при авитаминозе К возникают самопроизвольные паренхиматозные и капиллярные кровотечения (носовые кровотечения, внутренние кровоизлияния). Кроме того, любые поражения сосудов (включая хирургические операции) при авитаминозе К могут привести к обильным кровотечениям. У человека авитаминоз К встречается реже, чем другие авитаминозы. Объясняется это двумя обстоятельствами: во-первых, смешанная пища довольна богата витамином К (витамины группы К синтезируются в зеленых растениях и некоторыми микроорганизмами); во-вторых, синтезируемого кишечной микрофлорой количества витамина К вполне достаточно для предотвращения авитаминоза. Авитаминоз обычно развивается при нарушении процесса всасывания жиров в кишечнике. У детей грудного возраста часто возникают обильные подкожные кровотечения и кровоизлияния; они наблюдаются и при так называемом геморрагическом диатезе, являющемся следствием недостаточности свертывания крови у матери.
Биологическая роль. Витамин К принимает участие в синтезе протромбина в печени, вероятнее всего, через ферментную систему. Получены доказательства, что витамин К необходим как стимулятор биосинтеза в печени минимум 4 белков-ферментов, участвующих в сложном процессе свертывания крови: факторов II, VII, IX, X. В частности, имеются данные, что в молекуле указанных факторов обязательно присутствуют остатки карбоксиглутаминовой кислоты; в молекуле активного протромбина таких остатков оказалось 10. Протромбин, являясь протеолитическим ферментом, расщепляет специфические пептидные связи растворимого белка крови фибриногена с образованием нерастворимого фибрина. Показано, что γ-карбоксилирование остатков глутаминовой кислоты в молекуле белков, в частности протромбина, протекает посттрансляционно при участии γ-глутамилкарбоксилазы, требующей наличия витамина К; источником СО2 является НСО3–. В этой реакции витамин К выполняет, по-видимому, кофакторную функцию.
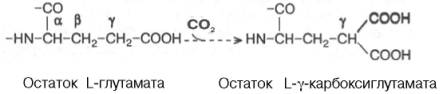
Реакция постсинтетического карбоксилирования γ-карбоксильной группы глутамата играет, кроме того, важную роль в связывании ионов Са2+ молекулой белка, поскольку при этом образуются дополнительные отрицательно заряженные ионы карбоксильных групп. Следует указать, что биотин не участвует в этой реакции карбоксилирования.
Одним из мощных антивитаминов К является природное вещество дикумарол (дикумарин). Введение его вызывает резкое снижение в крови протромбина и ряда других белковых факторов свертывания крови и соответственно вызывает кровотечения. Аналогичным свойством в качестве антикоагулянта обладает синтетический аналог витамина К варфарин, который действует как конкурентный ингибитор тромбообразования.
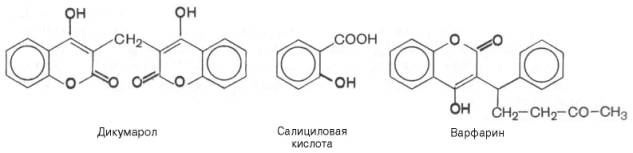
Способность дикумарола и варфарина снижать свертываемость крови в дальнейшем стали широко использовать для лечения болезней человека, характеризующихся повышенной свертываемостью крови. В частности, при коронарных тромбозах, тромбофлебитах оба эти препарата способствуют разжижению сгустка крови, оказывая эффективное лечебное действие. В случае возникновения кровотечения после введения дикумарола или варфарина больным назначают препараты витамина К.
Распространение в природе и суточная потребность. Наиболее богаты витамином К растения, в частности зеленые листья каштана, крапивы, люцерны. К растительным продуктам, богатым витамином К, относятся капуста, шпинат, тыква, зеленые томаты, арахисовое масло, ягоды рябины и т.д. В животных продуктах, кроме печени свиньи, он почти нигде не содержится. Суточная потребность в витамине К для человека точно не установлена, поскольку он синтезируется микроорганизмами кишечника; считается достаточным количество около 1 мг.
