
- •2. Перечислите, по каким признакам можно установить протекание химической реакции. Какие из этих признаков вы наблюдали.
- •3. Изобразить схему связи классов неорганических соединений на конкретных примерах.
- •5. Какие из неорганических оснований относятся к щелочам.
- •6. Напишите уравнение реакции между кислотой и основанием, приводящее к образованию а)кислой соли, б) основной соли.
- •8. Приведите по три примера: а) солеобразующих и б) несолеобразующих оксидов.
- •9) Приведите примеры: а) металлов и б) неметаллов, не реагирующих с водой.
- •10) Назовите не менее пяти простых веществ и приведите уравнения реакций получения каждого из веществ.
- •11) Приведите примеры образования соли: а)из двух простых веществ, б)из двух сложных веществ, г)из простого и сложного вещества.
- •12) Приведите графические формулы ангидридов следующих кислот: а) серной, б)хлорной, в)хлорноватой, г)хлорноватистой, д) дихромовой, е)ортофосфорной, ж)пирофосфорной, з)метакремниевой, и)борной.
- •13) Приведите примеры реакции взаимодействия растворов щелочей со следующими простыми веществам: а) галогенами, б)серой, в) белым фосфором, г) кремнием, д) алюминием, е) цинком.
- •14) Какие из двух кислот сильные и почему: а) хлорная и хлористая, б)азотная и азотистая, в) серная и серистая.
12) Приведите графические формулы ангидридов следующих кислот: а) серной, б)хлорной, в)хлорноватой, г)хлорноватистой, д) дихромовой, е)ортофосфорной, ж)пирофосфорной, з)метакремниевой, и)борной.
а) H2SO4 – серная кислота ,

б)
Хлорная
кислота ![]()

в) Хлорноватая кислота — HClO3

г) Хлорноватистая кислота — HClO

д) дихромовая Н2Cr2О7 более сильная
е) Ортофо́сфорная кислота́ (фо́сфорная кислота́) — неорганическая кислота средней силы, с химической формулой H3PO4,
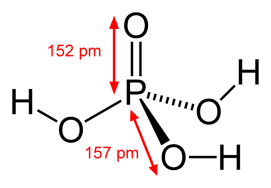
ж)
Традиционные названия |
Дифосфорная кислота, пирофосфорная кислота |

з) Формула: H2SiO3
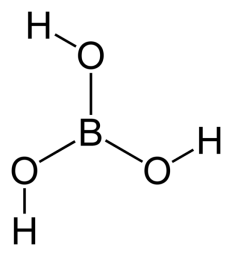
и) Бо́рная кислота́ (ортоборная кислота) — слабая кислота, имеющая химическую формулу H3BO3.
13) Приведите примеры реакции взаимодействия растворов щелочей со следующими простыми веществам: а) галогенами, б)серой, в) белым фосфором, г) кремнием, д) алюминием, е) цинком.
а)
б) сера с щелочами: SO2 + 2NaOH = Na2SO4 + H2O SO3 + 2NaOH = Na2SO4 + H2O
в)

г) Кремний растворяется в горячем водном растворе щелочи с образованием растворимых солей кремниевой кислоты (силикатов) и выделением водорода: Si + 2NaOH + H2O = Na2SiO3 + 2H2.
д) Реакция алюминия и щелочи Получение водорода
Один из способов получения водорода в лаборатории основан на реакции алюминия с раствором щелочи - едкого натра или едкого кали. При этом образуется более чистый водород, чем в случае реакции кислот с активными металлами. Единственное, что его загрязняет - брызги щелочи, которые можно отделить с помощью каплеуловителя и слоя стекловаты. Насыпьте в колбу несколько грамм едкого натра или едкого кали, налейте примерно 50-100 мл воды и перемешайте содержимое до растворения щелочи. Добавьте в колбу несколько кусочков алюминия. Начнется выделение водорода - сначала слабое, потом все более сильное. Раствор при этом будет разогреваться. Алюминий - довольно активный металл, он легко реагировал бы с водой, если бы не прочная оксидная пленка на его поверхности. Поэтому алюминий может очень долго контактировать с водой без каких-либо признаков разрушения. Вспомните, что еще недавно на кухнях активно использовали алюминиевую посуду. Алюминиевые линии электропередач десятилетиями служат в любую погоду - и в солнце и в дождь. Но при контакте со щелочью оксидная пленка на поверхности алюминия разрушается, и он начинает реагировать с водой. В результате выделяется водород, а металл растворяется:
2Al + 6H2O = 2Al(OH)3 + 3H2 Al(OH)3 + NaOH = Na[Al(OH)4]
Теперь осторожно добавим в колбу примерно 10 гр щелочи и еще немного алюминия. Реакция значительно ускорится. Закроем колбу пробкой с трубкой, накройте отверстие трубки небольшой пробирочкой. Подождите, пока водород вытеснит воздух из колбы (3-5 мин) после чего снимите пробирку (не переворачивая) и поднесите к ее отверстию пламя. Если водород сгорит спокойно (без хлопка) подожгите газ на выходе из колбы. На воздухе водород горит бесцветным, почти невидимым пламенем, но брызги раствора едкого натра придают ему желтоватый цвет.
е) Цинк взаимодействует с щелочами: — при сплавлении с ними образуются соли цинковой кислоты — цинкаты. Zn + 2NаОН(крист.) = Nа2ZnО2 + Н2 — при взаимодействии с водным раствором щелочи образуется комплексная соль цинковой кислоты (гидроксоцинкат натрия) Zn + 2NаОН + 2Н2О = Na[Zn(ОН)4] + Н2
