
- •1. Основные положения
- •§ 1. Предмет технической
- •§ 2. Термодинамическая система.
- •Лекция 2
- •§ 1. Уравнения состояния идеальных
- •§ 2. Газовые смеси
- •Лекция 3 теплоемкость газов
- •§ 1. Истинная и средняя теплоемкости
- •§ 2. Изобарная и изохорная
- •1. Значения молярных теплоемкостей и коэффициента k в зависимости от атомности
- •§ 3. Теплоемкость газовых смесей
- •Лекция 4 первый закон термодинамики
- •§ 1. Термодинамический процесс
- •§ 2. Работа расширения газа
- •§ 3. Теплота
- •§ 4. Первый закон термодинамики
- •Лекция 5 термодинамические процессы в газах
- •§ 1. Метод исследования
- •§ 2. Изохорный процесс
- •§ 3. Изобарный процесс
- •§ 4. Энтальпия газа
- •§ 5. Изотермический процесс
- •§ 6. Адиабатный процесс
- •§ 7. Политропный процесс
- •§ 8. Анализ политропных процессов
- •2. Результаты анализа политропных процессов
- •Лекция 6 второй закон термодинамики
- •§ 1. Круговые процессы
- •§ 2. Прямой обратимый цикл карно
- •§ 3. Обратный обратимый цикл карно
- •§ 4. Сущность и формулировки
- •§ 1. Общие понятия об идеальных циклах
- •§ 2. Циклы газотурбинных установок
- •§ 3. Термодинамические основы работы
- •Лекция 8 водяной пар
- •§ 1. Основные понятия и определения
- •§ 3. Основные термодинамические
- •Лекция 9 циклы паросиловых установок
- •§ 1. Цикл карно для водяного пара
- •§ 2. Цикл ренкина
- •§ 3. Влияние основных параметров пара
- •Лекция 10 влажный воздух
- •§ 1. Физические свойства
- •Лекция 11 основы теплообмена план
- •1. Теплопроводность
- •§ 1. Основные понятия и определения
- •§ 2. Закон фурье
- •§ 3. Частные случаи теплопроводности
- •Лекция 12 конвективный теплообмен. Теплообмен излучением
- •§ 1. Общие понятия
- •§ 2. Особенности теплоотдачи
- •§ 3. Основные понятия
- •§ 4. Некоторые задачи
- •Лекция 13 теплопередача. Сновы расчета теплообменных аппаратов
- •§ 1. Теплопередача через плоскую стенку
- •§ 2. Теплопередача через цилиндрическую стенку
- •§ 3. Интенсификация теплопередачи.
- •§ 4. Теплообменные аппараты
- •Лекция 14 топливо и основы теории процессов горения
- •14. Энергетическое топливо
- •§ 1. Классификация топлива
- •§ 2. Состав топлива
- •3. Общая классификация топлив
- •§ 3. Теплота сгорания топлива.
- •§ 4. Теплотехническая характеристика
- •§ 5. Характеристика отдельных
- •Лекция 15 основы процесса горения топлива
- •§ 1. Сущность процесса горения топлива
- •§ 2. Определение необходимого
- •§ 3. Объем и состав продуктов сгорания
- •§ 4. Энтальпия и теплоемкость
- •4. Численные значения энтальпий составляющих продуктов сгорания и воздуха при различных температурах
1. Значения молярных теплоемкостей и коэффициента k в зависимости от атомности
Газ |
с |
ср |
с |
ср |
k |
ккал/кмоль . 0С |
кДж/(кмоль . К) |
||||
Одноатомный |
3 |
5 |
12,6 |
20,9 |
1,67 |
Двухатомный |
5 |
7 |
20,9 |
29,2 |
1,4 |
Трех- и многоатомные |
7 |
9 |
29,2 |
37,5 |
1,29 |
Важным соотношением при термодинамических исследованиях, является коэффициент k
 (30)
(30)
Из уравнения (30), используя (26), имеем:
![]() (31)
(31)
Откуда
с = R / (k – 1), (32)
следовательно,
![]() (33)
(33)
§ 3. Теплоемкость газовых смесей
Теплоемкость газовой смеси, как и отдельных газов, может быть отнесена к 1 кг, 1 м3 или 1 кмолю.
Если смесь задана массовыми долями, то ее массовую теплоемкость определяют по формуле:
cсм = g1c1 + g2c2 + g3c3 +…+gncn, (34)
где g1c1, g2c2, …, gncn – произведения массовой доли каждого газа, входящего в состав смеси на его массовую теплоемкость в данном процессе.
При аналогии при задании компонентов смеси объемными долями r1, r2, r3,… rn и объемными теплоемкостями имеем:
cсм = r1c1 + r2c2 + r3c3 + …+ rncn. (35)
Контрольные вопросы и задания. 1. Дайте определение средней и истинной теплоемкостей. 2. Укажите размерности массовой, объемной и молярной теплоемкостей. 3. Как определяются массовая и объемная теплоемкости на основании молярной теплоемкости? 4. От каких параметров зависит теплоемкость? 5. Как определить при помощи таблиц (см. приложение 3) средних теплоемкостей количество теплоты на нагрев произвольной массы газа от t1 до t2 0С? 6. Напишите выражение для массовой теплоемкости смеси идеальных газов при задании смеси массовыми долями.
Лекция 4 первый закон термодинамики
Первый закон термодинамики является частным случаем закона сохранения и превращения энергии. Закон сохранения и превращения энергии, определяющий эквивалентность между теплотой и механической работой, устанавливает, что из данного количества теплоты при полном превращении ее в работу получается строго определенное и всегда одно и то же количество работы.
§ 1. Термодинамический процесс
В результате воздействия на рабочее тело (газ, пар) внешней среды, например сжатия, расширения, нагрева и т. д. происходит изменение параметров его состояния.
Всякое изменение параметров состояния рабочего тела называется термодинамическим процессом.
Как отмечалось выше, различают равновесные и неравновесные состояния рабочего тела. Термодинамический процесс, при котором система проходит через непрерывный ряд равновесных состояний, называется равновесным. Основным условием равновесного состояния рабочего тела является равенство температуры и давления по всей его массе. Равновесные процессы обратимы.
Неравновесными процессами называются реальные процессы, протекающие с конечной скоростью, при этом работа, затрачиваемая на сжатие, будет больше, чем в равновесном процессе (за счет сил трения, инерции и т. п.).
Неравновесные процессы необратимы.
При изучении термодинамических процессов используют их графические изображения, в частности в системе координат и , называемой -диаграммой.
По оси ординат откладывают абсолютные давления , а по оси абсцисс – удельные объемы газа. При известных величинах и равновесное состояние изображается точкой.
На рисунке 1 изображен произвольный равновесный процесс. При переходе газа из начального состояния 1 в конечное 2 имеет место снижение давления и увеличение удельного объема. Это процесс расширения, который считается прямым процессом. Процесс сжатия (от точки 2 к точке 1) считается обратным.
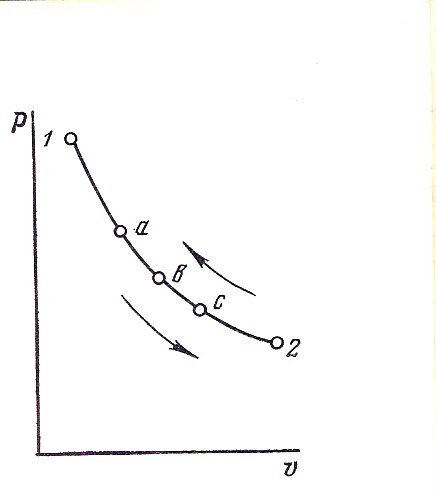
Рис. 1. Изображение равновесного (обратимого) процесса в -диаграмме.
