
- •1.Назовите основные параметры состояния рабочего тела при отсутствии внешних силовых полей.
- •1.Назовите закон Бойля Мариотты и Гей Люсака
- •1.Назовите виды изопроцессов.
- •1.Различите по направлению протекания прямые и обратные циклы.
- •Назовите основные процессы, протекающие в координатах t-s
- •1.Удельной энтальпией влажного воздуха
- •1.Назовите основные виды компрессоров по принципу действия
- •Назовите назначение компрессора
- •Назовите рабочее тело двигателя внутреннего сгорания
- •Дайте определение понятию мертвая точка
- •1.Назовите типы газотурбинных установок в зависимости от способу подвода теплоты к рабочему телу.
- •1.Назовите циклы паросиловой установки
- •1.Назовите отличие цикла Карно для насыщенного пара от цикла Ренкина
- •1.Дайте определение понятия «Истичение»
- •1.Назовите назначение холодильной машины.
- •Передача теплоты через плоскую стенку: а - однослойную; б - многослойную
- •4. Применение теплоизоляционых материалов, размещение камер близких по температуре.
- •1.Перечислите теплообменные аппараты по принципу взаимодействия сред
- •Назовите схемы движения сред в теплообменных аппаратах
- •1.Назовите виды теплообмена
- •Назовите различие однослойной стенки от многослойной.
1.Назовите основные параметры состояния рабочего тела при отсутствии внешних силовых полей.
удельный объём, абсолютное давление и абсолютная температура.
2.Избыточное давление(Ризб.)-это разность между давлением жидкости или газа (Рабс.) и давлением окружающей среды(Ратм.).
Абсолютное давление-это действительное давление рабочего тела внутри сосуда.
3.Абсолютное давление в котле определяется:
Рабс.=Ризб.+Ратм.=32+0.99=32.99 бар=3299000 Па.
4. увеличится
1.Назовите закон Бойля Мариотты и Гей Люсака
Закон Бойля-Мариотта: при постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение обьема на давление будет постоянным. T=const. V.P=const.
Закон Гей-Люссака: при постоянном давлении и неизменных значениях массы газа и молярной массы, отношение объема газа к его температуре остается постоянным. P=const. V/T=const.
2.Идеальный газ-математическая модель газа, в которой потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Идеальным принято считать газ, если:
А) между молекулами отсутствуют силы притяжения, т.е. молекулы ведут себя как абсолютные упругие тела.
Б) газ очень разрежен, т.е. расстояние между молекулами намного больше размеров самих молекул.
В)тепловое равновесие по всему объему достигается мгновенно.
3. Для решения задачи используем уравнение Менделеева-Клайперона: PV=m/M.R.T.
Исходя из данных, воспользуемся уравнением идеального газа:PV=vRT
Объем газа из этого уравнения равен V=vRT/P
P=1.25.102 Па
R=8.314 кДж.(моль.К)
V=2 моль
T=6000K
V-?
V=2 моль.8.3 Дж.моль-1.К-1.6000К/1.25.102 Па=796.8 м3
4. Спрогнозируйте, какие параметры будет иметь изолированная термодинамическая система.
Ответ: термодинамическая система - группа тел, тело или часть тела, которые взаимодействуют , как между собой, так и с окружающей средой. Все тела находящиеся за пределами границ рассматриваемой системы называются окружающей средой. Например: т.д. система – газ, находящейся в цилиндре с поршнем, а окружающая среда – цилиндр, поршень, воздух, стены помещения. Изолированная система характеризуется постоянством массы m, объема V, энергии U (m=соnst, V= соnst, U= соnst) она не обменивается с окружающей средой ни веществом, ни энергией, т.е. т/д система не взаимодействует с окружающей средой.
1.Закон Дальтона: общее давление смеси идеальных газов равно сумме парциальных давлений каждого газа в смеси. Например, дана смесь идеального газа из азота (N2), водорода (H2) и гелия (He), тогда:
Pсмеси=Pазота+Pводорода+Pгелия или Р = Р1 +Р2+Р3+...Рn = ∑ Рi
где Pазота- парциальное давление азота,
Pводорода- парциальное давление водорода,
Pгелия- парциальное давление гелия.
Или где Р1 , Р2 , Р3 . . .Рn – парциальные давления.
2. Газовая смесь - это смесь отдельных газов, не вступающих между собой в какие-либо химические реакции. Каждый газ (компонент) в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси.
Термодинамические свойства смесей идеальных газов
В теплотехнических установках теплоноситель или рабочее тело часто представляют собой смесь газов при невысоком давлении, когда их можно рассматривать как идеальные газы. Схема получения такой смеси, состоящей из двух компонентов, показана на рис.

До смешения компоненты находятся в объемах V1 и V2 при одинаковом давлении p и одинаковой температуре T. Массы газов и их калорические свойства (внутренние энергии, энтальпии, теплоемкости и др.), естественно, различны. После того как убрана перегородка, газы вследствие диффузии перемешиваются, так что каждый из них занимает полный объем Vсм а давление каждого газа будет равно парциальному давлению
3.Для решения задачи используем уравнение Менделеева-Клайперона
PV=(m/M).R.T
m/M=PV/RT
m=MРV/RT
V=10м3
P=5.106Па
T=20oC=293.15K
R=8.314 кДж(моль.К)
М(кислород)=16 г/моль=0,016 кг/моль
m=0.016.5.106Па.10м3/8.314.293.15=328 кг
4.Уменьшится, т.к. массовая доля i-того компонента определяется отношением массы этого компонента к массе всей смеси, а т.к. при добавлении в смесь массой 6 кг еще 0,8 кг 3-ого компонента , масс доля уменьшится. gi=mi/mсм
Физический смысл парциального давления Pi состоит в том, что это есть давление i-го газа при условии, что он занимал бы объем V.
Закон Дальтона. Общее давление смеси идеальных газов равно сумме парциальных давлений каждого газа в смеси.
Pсмеси=P1+P2+P3+Pн=ΣPi
Закон Амага. Общий объём газовой смеси равен сумме парциальных объёмов каждого компонента. Vсмеси=V1+V2+V3+Vн=ΣVi
Дано:
U1-U2=48Дж
L=10Дж
Q-?
Решение:
Q=(U2-U1)+L
Q=48+10=58000кДж
Ответ:58000кДж
4. Объемная доля гелия в составе газовой смеси при давлении в неё 12м3 кислорода уменьшается так как: Vi=Vi/Vсм=V1/Vi где Vi объёмная доля i-го компонента.
Если добавляется в объём смеси ещё какое вещество то Vсм увеличивается а Vi компонента остаётся прежним и зная формулу дня нахождения объёмной доли i-го компонента можно сказать что: объемная доля гелия в составе газовой смеси при давлении в неё 12м3 кислорода уменьшается
1.Энтальпия – это теплота подводимая к телу в процессе нагрева при постоянном давлении.
2.Первый закон термодинамики является основой термодинамической теории и имеет огромное прикладное значение при исследовании термодинамических процессов. Совокупность изменений состояния термодинамической системы при переходе из одного состояния в другое под воздействием окружающей среды называют термодинамическим процессом. Он может быть равновесным и неравновесным.Q=(U2-U1)+L
Первый закон термодинамики является законом сохранения и превращения энергии: Энергия не исчезает и не возникает вновь, она лишь переходит из одного вида в другой в различных физических процессах.
По другому это закон можно формулировать так; для того чтобы изменить внутреннюю энергию тела нужно либо совершить над ним работу, либо передать какое – либо количество теплоты ему. Например, если мы хотим согреть руки, то можно погреть их у батареи либо потереть друг об друга.
3.Дано:
Q-?
Решение:
Q=(U2-U1)+L
Q=40+8=48000кДж
Ответ:48000кДж
4. От внешних сил которые будут действовать на систему.
Теплоёмкость – это свойство материала поглощать определённое количество тепла при нагревании и выделять его при охлаждении Дж /(кг*К)
Удельная теплоемкость – это количество тепла необходимого для нагревания единицы количества вещества на один градус Дж /(кг*К)
Массовая теплоемкость – это количество теплоты, которое необходимо подвести к единице массы вещества чтобы нагреть его на единицу температуры Дж (кмоль*К)
Объемная теплоемкость – это количество теплоты, которое необходимо подвести к единице объема вещества чтобы нагреть его на единицу температуры.
Мольная теплоемкость – это количество теплоты, которое нужно к подвести единице моля вещества, чтобы нагреть его на единицу температуры.
Дано:
(Сpm)0800=1,0710 кДж / (кг·град)
(Сpm)0200=1,0115 кДж / (кг·град)
Решение:
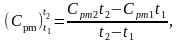
Подставив найденные значения в исходную формулу получаем:

Ответ:
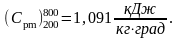
4. Если увеличить подвод тепла то теплоёмкость будет
увеличиваться.
Теплоёмкость – это свойство материала поглощать определённое количество тепла при нагревании и выделять его при охлаждении.(С, Дж/К)
Уравнение Майера – уравнение, устанавливающее связь между теплоёмкостями при постоянном давлении Cp и постоянном объёме С V 1 К/моля идеального газа: Ср-Сv=R.
3. Дано:
Q=2010кДж
t1=20C
t2=115C
m=21кг
С-?
Решение:
Количество теплоты необходимое на нагрев тела определяется по формуле:
Q=mc(t2-t1)
Откуда выражаем теплоёмкость:
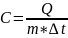
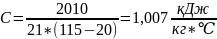
4.При уменьшении массы вещества, теплоёмкость будет уменьшаться.
