
- •Термодинамическая система. Уравнение состояния.
- •Параметры состояния системы
- •Уравнение состояния
- •Смеси идеальных газов
- •Первый закон термодинамики
- •Теплоемкость газов
- •1.2. Термодинамические процессы идеального газа
- •Второй закон термодинамики
- •Термодинамика открытых систем
- •Термодинамические процессы в компресорах
- •Циклы двигателей внутреннего сгорания
- •Общий принцип работы двигателей внутреннего сгорания
- •Цикл Отто (Цикл д. В. С. С подводом тепла при постоянном объёме)
- •Цикл Дизеля (цикл д. В. С. С подводом тепла при постоянном давлении)
- •Цикл Тринклера (цикл д. В. С. Со смешанным подводом тепла)
- •Сравнение эффективности идеальных циклов
- •Цикл газотурбинной установки
- •Цикл паротурбинной установки
- •Обратные циклы в технике
- •Цикл парокомпрессионной холодильной установки
- •Цикл теплового насоса
- •Источники получения тепловой энергии
- •Виды и состав топлив
- •Теплота сгорания топлива
- •Расход воздуха на сжигание топлива
- •Объем и состав продуктов сгорания
- •Энтальпия продуктов сгорания
- •2 Теория теплообмена
- •Основные понятия
- •Теплопроводность
- •Температурное поле. Закон Фурье
- •Дифференциальное уравнение теплопроводности
- •Теплопроводность через плоскую стенку при граничных условиях первого рода.
- •Теплопроводность через цилиндрическую стенку при граничных условиях первого рода.
- •2.3.Тепловая конвекция
- •Основные понятия
- •Дифференциальные уравнения конвективного теплообмена.
- •Теплоотдача при вынужденной и свободной конвекции
- •Теплопроводность через плоскую и цилиндрическую стенку при граничных условиях третьего рода (теплопередача).
- •Теплообмен излучением
- •Основные понятия и законы теплового излучения
- •Теплообмен излучением системы тел в прозрачной среде
- •Теплообмен излучением в газовой среде
- •Теплообменные аппараты
- •Класификация теплообменных аппаратов
- •Основы расчета теплообменного аппарата
- •Рекомендуемая литература:
Теплоемкость газов
Под теплоемкостью газа (удельной теплоемкостью) понимают количество тепла, необходимое для нагревания количественной единицы газа (1 кг, 1м3, 1 киломоль) на 10С (или 1 К). В соответствии с этим различают теплоемкость массовую, объемную и мольную.
![]()
![]()
![]() ,
(1.35)
,
(1.35)
где
![]() удельная
массовая теплоемкость (Дж/кг.К,
кДж/кг.К),
удельная
массовая теплоемкость (Дж/кг.К,
кДж/кг.К),
![]() удельная
объемная теплоемкость (Дж/м3.К,
кДж/м3.К),
удельная
объемная теплоемкость (Дж/м3.К,
кДж/м3.К),
![]() мольная
теплоемкость (Дж/кмоль.К,
кДж/кмоль.К).
мольная
теплоемкость (Дж/кмоль.К,
кДж/кмоль.К).
При этом имеют место соотношения:
![]()
![]() .
(1.36)
.
(1.36)
Величина теплоемкости зависит от рода газа, его температуры, давления и условий нагрева газа.
Теплоемкость газовой смеси определяется через теплоемкости компонентов:
![]()
![]()
![]() (1.37)
(1.37)
Теплоемкость,
как и теплота процесса, зависит от
характера процесса, что обозначается
индексом процесса
![]() например:
например:
![]()
Чаще
всего используется теплоемкость при
постоянном объеме -
![]() и теплоемкость при постоянном давлении
-
и теплоемкость при постоянном давлении
-![]() .
.
![]()
![]() (1.38)
(1.38)
Из
(1.26) при
![]() получаем
получаем
![]() а из (1.29) при
а из (1.29) при
![]() получаем
получаем
![]() .
Отсюда:
.
Отсюда:
![]()
![]() .
(1.39)
.
(1.39)
![]()
![]() .
(1.40)
.
(1.40)
Для идеального газа изобарная и изохорная теплоемкости связаны между собой уравнением Майера:
![]()
![]() .
(1.41)
.
(1.41)
Отношение изобарной теплоемкости и изохорной:
![]() .
(1.42)
.
(1.42)
В
классической теории теплоемкости
теплоемкость идеальных газов не зависит
от температуры и определяется числом
степеней свободы поступа-тельного и
вращательного движения молекул газа
-![]() .
.
![]() ,
,
![]() ,
,
![]() (1.43)
(1.43)
Для
одноатомных газов
![]()
![]() для двухатомных
для двухатомных
![]()
![]() ,
для трехатомных
,
для трехатомных
![]()
![]()
Однако
теплоемкость реальных газов зависит
от температуры, что объясняет квантовая
теория теплоемкости, учитывающая
колебательные степени свободы. Поэтому
наряду с истинной теплоемкостью,
определяемой по (1.35), вводится средняя
теплоемкость в интервале температур
от![]() до
до
![]() :
:
 .
(1.44)
.
(1.44)
Значения
истинной теплоемкости при заданной
температуре
![]() (оС)
и средней теплоемкости в интервале
температур от 0(оС)
до
(оС)
приводятся для различных газов в
справочных таблицах.
(оС)
и средней теплоемкости в интервале
температур от 0(оС)
до
(оС)
приводятся для различных газов в
справочных таблицах.
Количество теплоты, необходимой для нагревания газа от температуры до температуры , определяется по формуле:
![]() (1.45)
(1.45)
1.2. Термодинамические процессы идеального газа
Задачей исследования термодинамических процессов является нахождение зависимостей и величин, характеризующих эти процессы:
уравнений, описывающих процесс;
аналитической взаимосвязи между параметрами рассматриваемого процесса, т.е. связи между параметрами p, v, T;
величины изменения внутренней энергии за процесс;
величины изменения энтальпии рабочего тела за процесс;
величины работы изменения объема рабочего тела и располагаемой работы;
количества тепла, подведенного за время процесса к рабочему телу или отведенного от него.
Изохорный процесс – процесс, протекающий при постоянном объеме.
![]()
![]() n=
n=![]()

Уравнение, связывающее параметры начального и конечного состояний:
![]()
![]()
![]() .
(2.1)
.
(2.1)
Работа процесса:
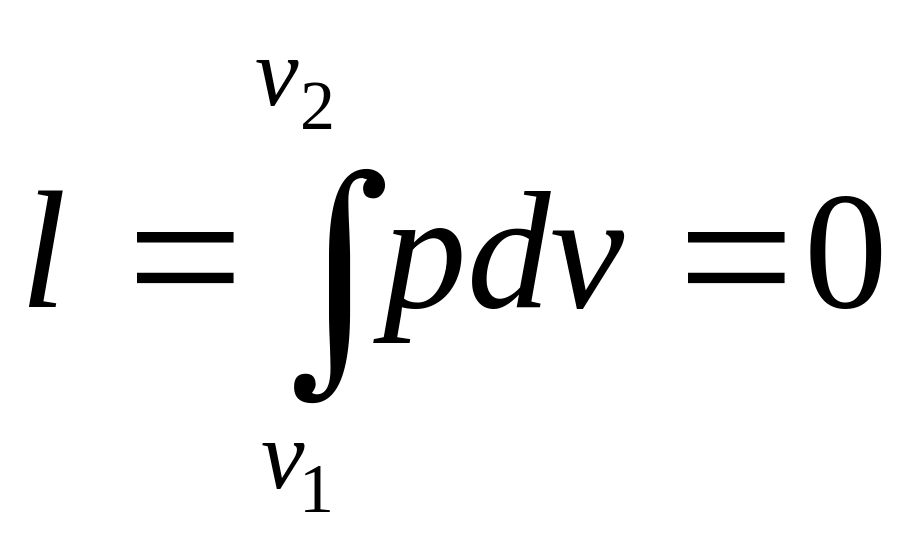 .
(2.2)
.
(2.2)
Располагаемая работа:
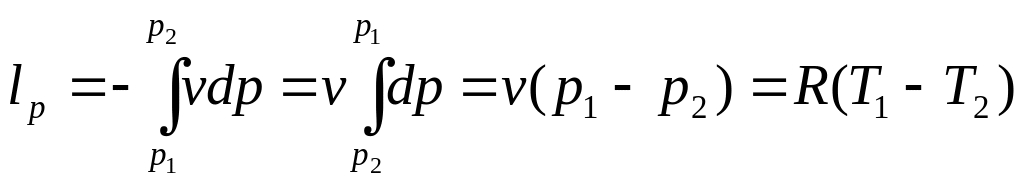 .
(2.3)
.
(2.3)
Теплота процесса:
![]()
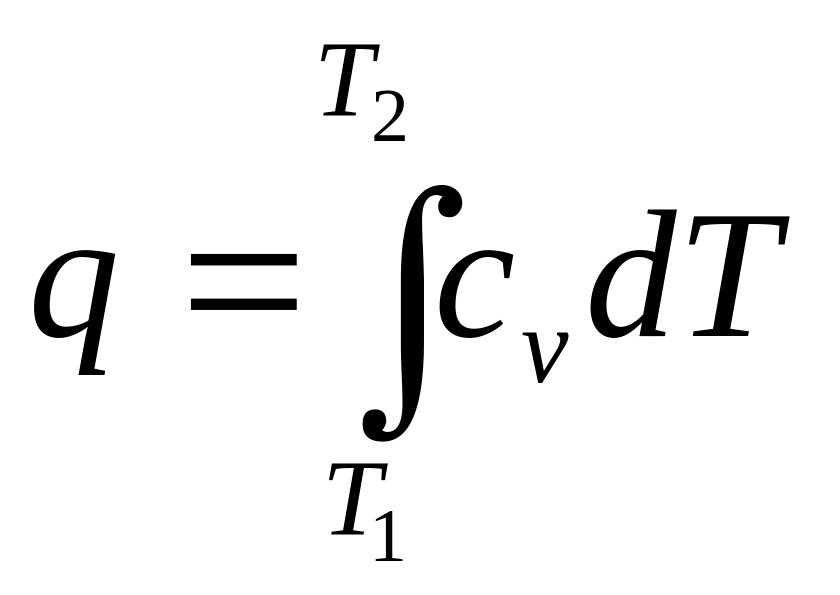 .
(2.4)
.
(2.4)
При
![]() :
:
![]() .
(2.5)
.
(2.5)
![]() .
(2.7)
.
(2.7)
Изменение термодинамических функций:
![]()
![]() .
(2.8)
.
(2.8)
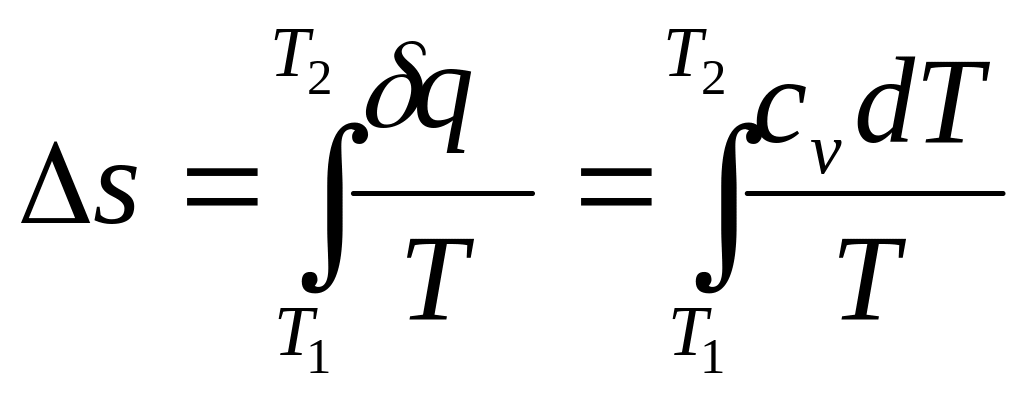 .
(2.9)
.
(2.9)
При
:
![]() ,
(2.10)
,
(2.10)
Изобарный процесс – процесс, протекающий при постоянном давлении:
![]() ,
,
![]() .
n=0.
.
n=0.

Уравнение, связывающее параметры начального и конечного состояний:
![]() ,
,
![]() ,
,
![]() .
(2.13)
.
(2.13)
Работа процесса:
 .
(2.14)
.
(2.14)
Располагаемая
работа:
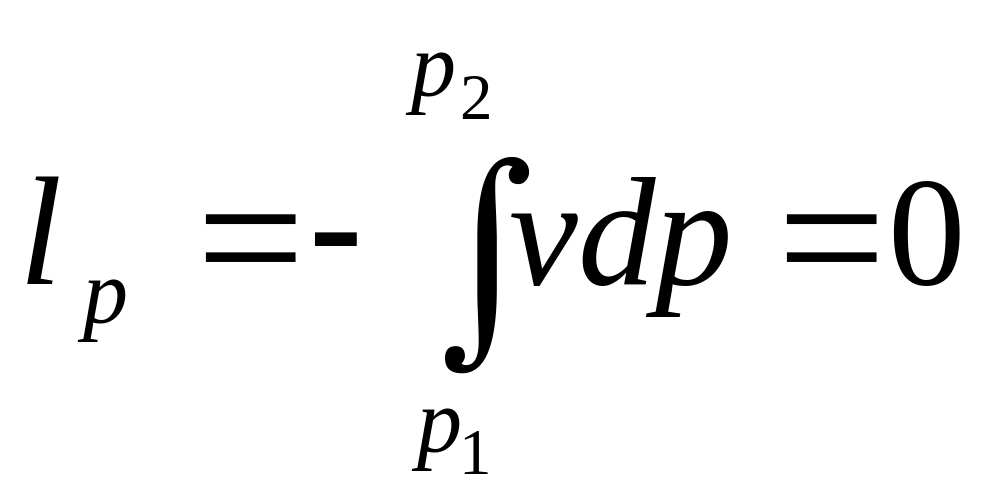 .
(2.15)
.
(2.15)
Теплота процесса:
![]() ,
,
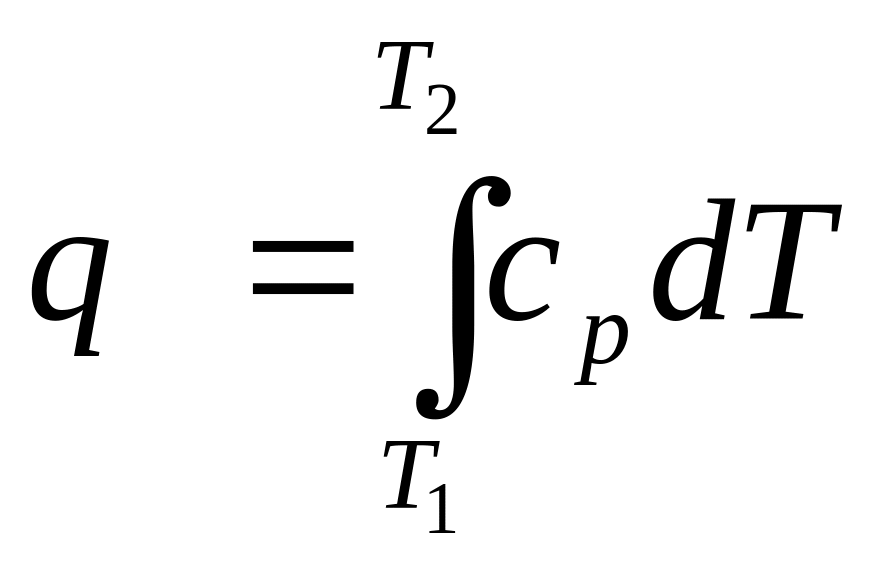 .
(2.16)
.
(2.16)
При
![]() :
:
![]() .
(2.17)
.
(2.17)
Изменение термодинамических функций:
![]() ,
,
![]() .
(2.20)
.
(2.20)
Изменение энтропии в изобарном процессе:
![]() .
(2.23)
.
(2.23)
Изотермический
процесс –
процесс, протекающий при постоянной
температуре:
![]() .
n=1
.
n=1
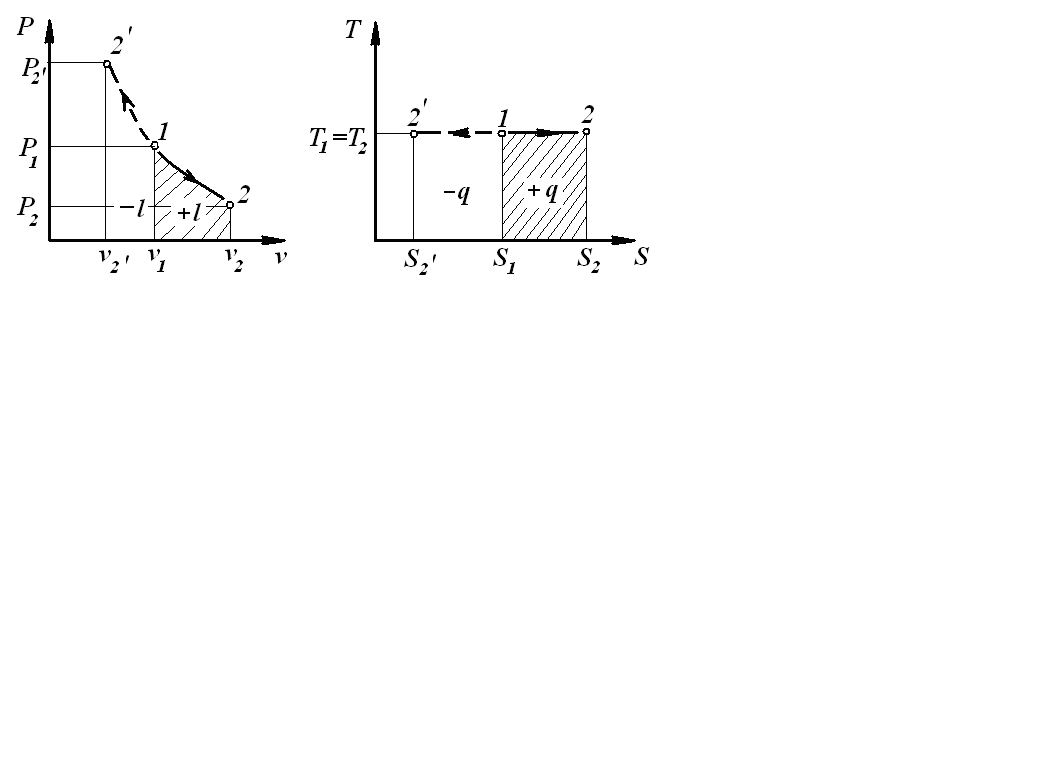
Уравнение, связывающее параметры начального и конечного состояний:
![]() ,
,
![]() .
(2.26)
.
(2.26)
Работа
процесса:
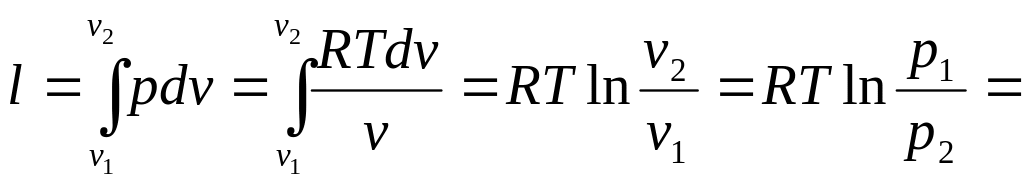
![]() .
(2.27)
.
(2.27)
Располагаемая работа:
 (2.28)
(2.28)
Теплота
процесса (с учетом того, что при
для идеального газа
![]() ):
):
![]() (2.29)
(2.29)
Изменение термодинамических функций:
![]() ,
,
![]() (2.30)
(2.30)
![]() (2.31)
(2.31)
Адиабатный (изоэнтропный) процесс – процесс, протекающий без теплообмена с окружающей средой.

Уравнения, связывающие параметры начального и конечного состояний:
![]() ,
,
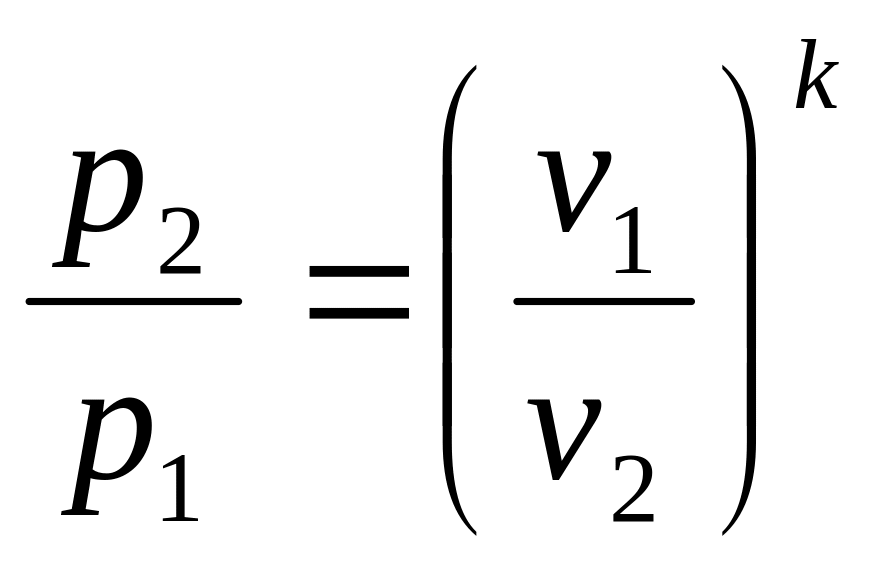 .
(2.32)
.
(2.32)
![]() ,
,
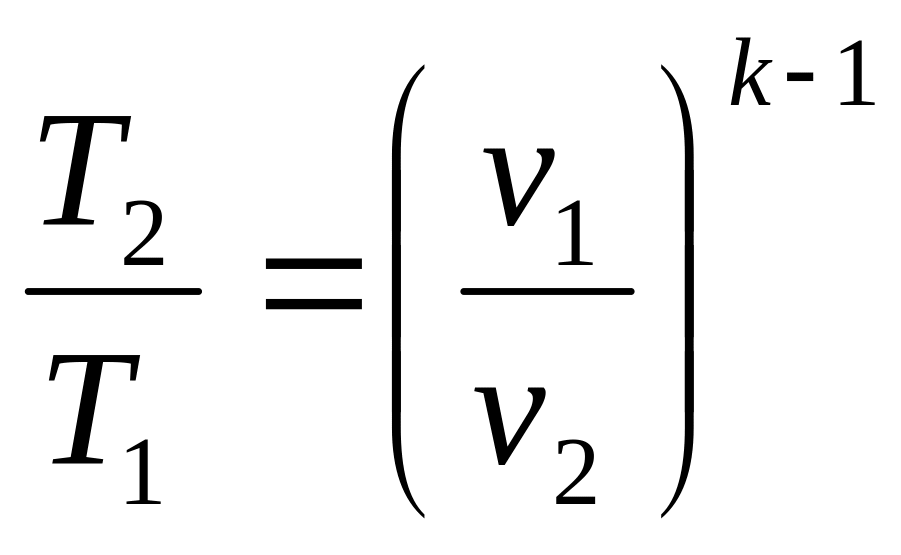 .
(2.33)
.
(2.33)
![]() ,
,
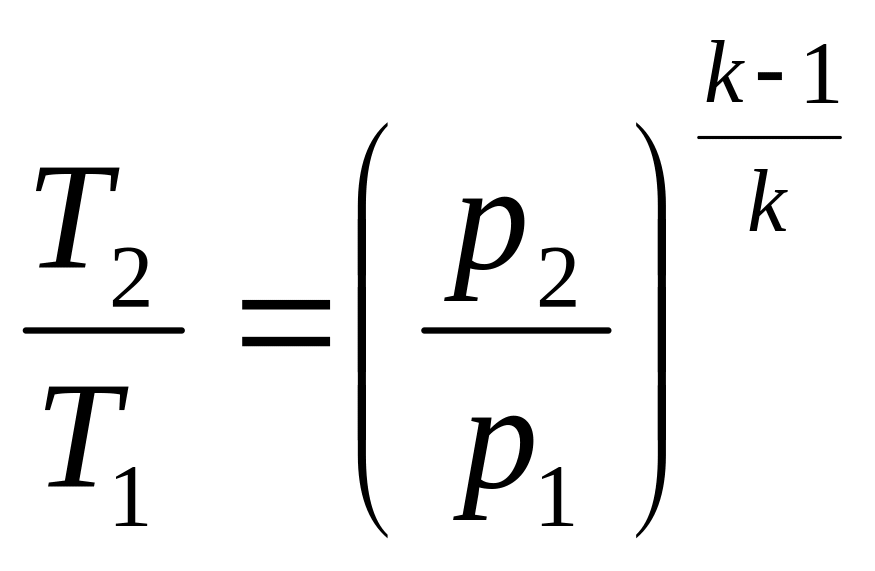 .
(2.34)
.
(2.34)
Адиабатический процесс — термодинамический процесс в макроскопической системе, при котором не происходит процесс теплообмена системы с окружающими телами. С точки зрения первого начала термодинамики это означает, что работа совершается газом только за счет внутренней энергии:
q = ∆u + l = 0;
Работа процесса:
![]()
![]()
=![]()
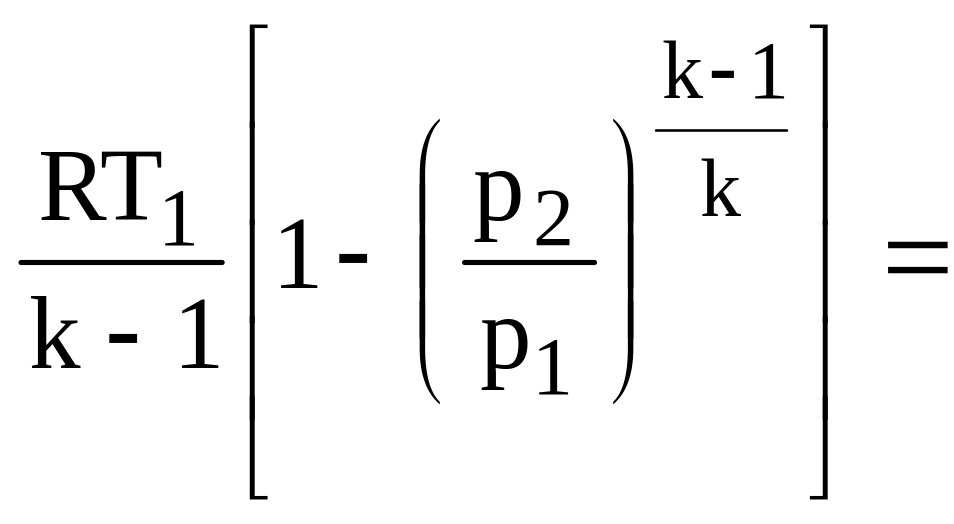
 (2.35)
(2.35)
Располагаемая
работа:
![]() .
(2.36)
.
(2.36)
Теплота
процесса:
![]() .
(2.37)
.
(2.37)
И зменение
термодинамических функций:
зменение
термодинамических функций:
![]() ,
(2.38)
,
(2.38)
![]() ,
,
![]() .
(2.39)
.
(2.39)
График адиабатного процесса — более крутая кривая, чем гипербола при изотермическом процессе. Это объясняется тем, что при адиабатическом сжатии 1—3 увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры.
Политропный
процесс – процесс,
протекающий при постоянной теплоемкости
![]() =const
и удовлетворяющий уравнению:
=const
и удовлетворяющий уравнению:
![]() (2.42)
(2.42)
где![]() - показатель политропы
- показатель политропы
![]() .
.
Это
уравнение отличается от уравнения
адиабаты (2.30) только показателем степени
(
вместо
![]() ).
Поэтому уравнения для параметров и
работы процесса получаются из уравнений
(2.30) – (2.34) заменой
на
.
).
Поэтому уравнения для параметров и
работы процесса получаются из уравнений
(2.30) – (2.34) заменой
на
.
Соотношение параметров в процессе:

Теплота процесса:
![]() ,
(2.43)
,
(2.43)
где
![]() теплоемкость политропного процесса:
теплоемкость политропного процесса:
![]()
![]() (2.44)
(2.44)
Изменение термодинамических функций:
![]() ,
,
![]() ,
,
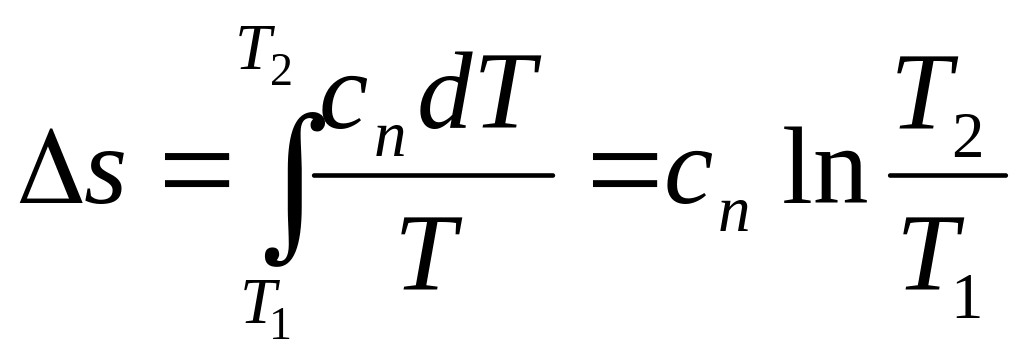 (2.45)
(2.45)
Работа расширения /сжатия в политропном процессе. dl =pdv ,
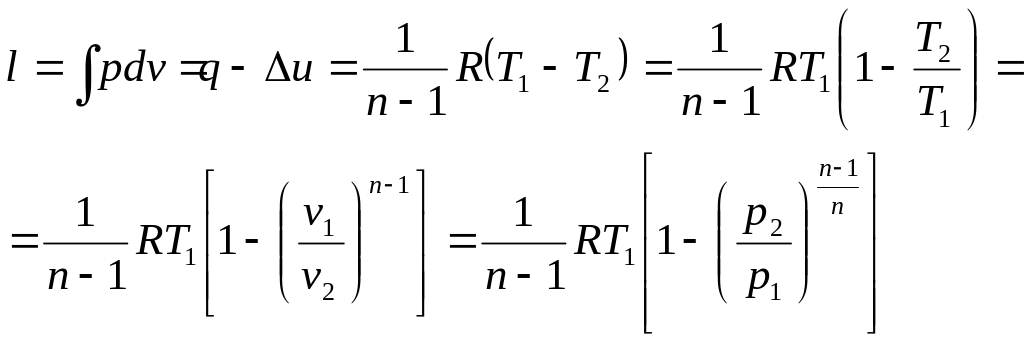 .
.
Располагаемая работа
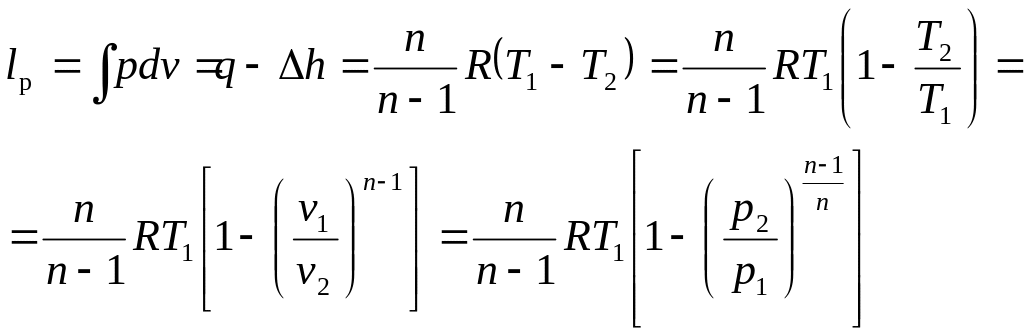
Обобщенная диаграмма политропных процессов.
Для анализа политропных процессов удобно пользоваться обобщенной диаграммой. На ней изображаются все изопроцессы и выделяются области, в пределах которых знаки слагаемых I закона одинаковы.
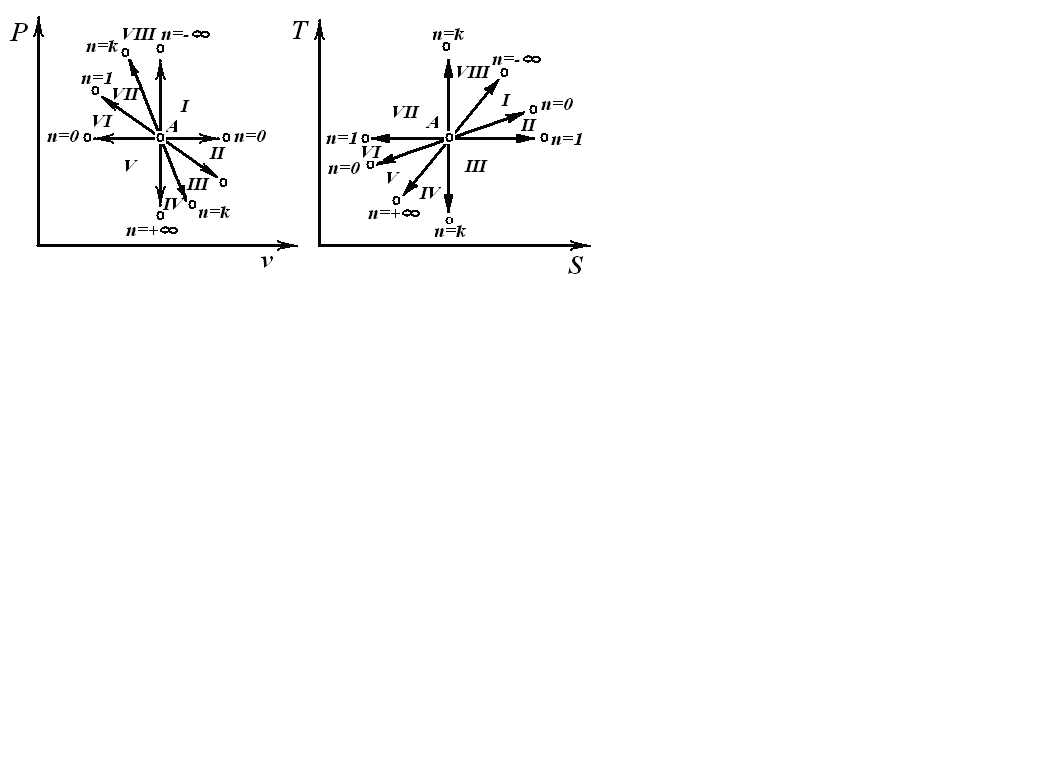
Области:
I÷IV – розширение рабочего тела, работа позитивна;
V÷VIII – сжатие рабочого тела, работа негативна;
I÷III,VIII – подвод теплоты к системе;
IV÷VIII – отвод теплоты от системы;
VII, VIII, I, II – повышение температуры системы;
III, IV, V, VI – понижение температуры системы.
Лекция
