
- •Изучение способов очистки сточных вод
- •Способы очистки сточных вод
- •Способы очистки сточных вод
- •1.1. Механическая очистка
- •1.2. Физико-химические методы очистки
- •1.3. Химические методы.
- •1.4. Электрохимические методы очистки.
- •1.5. Биологическая очистка
- •2. Требования, предъявляемые к сточной воде
- •3. Экспериментальная часть
- •Полуколичественное определение ионов, содержащихся в воде
- •3.1.1. Определение содержания хлоридов
- •3.1.2. Определение содержания катионов железа
- •4. Очистка воды
- •4.1. Механическая очистка
- •4.2. Химическая очистка
- •4.3. Физико-химическая очистка
- •Содержание в воде примесей до и после очистки (мг/л)
1.3. Химические методы.
К химическим методам очистки сточных вод относят нейтрализацию, коагулирование и флокулирование, окисление и восстановление. Химическая очистка проводится как доочистка вод перед биологической очисткой или после нее.
Нейтрализация. Сточные воды, содержащие кислоты или щелочи, перед сбросом в водоемы или перед технологическим использованием подвергаются нейтрализации. Практически нейтральными считаются воды, имеющие рН 6,5 – 8,5. Для нейтрализации кислых стоков используют щелочи, для нейтрализации щелочных – кислоты.
Нейтрализацию можно проводить различными путями: смешением кислых и щелочных сточных вод, добавлением реагентов, фильтрованием через нейтрализующие материалы. Для нейтрализации кислых вод используют щелочи (NaOH, KOH), соду (Na2CO3), аммиачную воду (NH4OH), карбонаты кальция и магния (CaCO3 и MgCO3), доломит (CaCO3*MgCO3), цемент. Однако наиболее дешевым реагентом является известковое молоко Ca(OH)2.
H+ + ОН ̄ → H2O
2 H+ + CaCO3 → Ca2+ + CO2 ↑ + H2O
Для нейтрализации щелочных сточных вод применяют отходящие газы, содержащие СО2, SО2, NО2, N2О3 и др. При этом происходит очистка дымовых газов от кислых компонентов.
SO2 + Са(ОН)2 = СаSО3↓ + Н2О
Метод реагентной (химической) обработки применяют для получения соединений, обладающих низкой степенью растворимости. Очистку сточных вод от ионов некоторых металлов (Cu+2, Ni+2, Fe+2 и др.) можно производить, используя щелочи. При рН = 8-9 обеспечивается наиболее полное осаждение труднорастворимых соединений меди, никеля и железа в результате реакции:
Ме2+ + 2ОН ̄ → Mе(ОН)2 ↓
Fе3+ + 3 Ca(OH)2 → Fe(OH)3↓ + 3Са2+
Cd2+ + S2-→ CdS↓
Рb2+ + CO32- → PbCO3↓
2Fе3+ + 3 СО32- +3Н2О → 2 Fe(OH)3↓ + 3СО2↑
Очистка окислением и восстановлением. Для очистки сточных вод используют следующие окислители: газообразный и сжиженный хлор, диоксид хлора, хлорную известь, гипохлориты кальция и натрия, перманганат калия, дихромат калия, перекись водорода, кислород воздуха, озон и др.
При окислении токсичные загрязнения переходят в менее токсичные с последующим удалением из воды. Очистка окислением связана с большим расходом реагентов, поэтому окисление используется тогда, когда загрязнители трудно извлечь другими способами.
Окисление хлором. Хлор и вещества, содержащие активный хлор являются наиболее распространенными окислителями. Их используют для очистки сточных вод от сероводорода, фенолов, цианидов и бактерий.
При обеззараживании вод от цианидов их окисляют до азота и диоксида углерода:
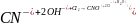
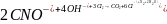
При хлорировании воды бактерии, находящиеся в воде, погибают в результате окисления веществ, входящих в состав протоплазмы клеток.
Окисление кислородом воздуха используется при очистке воды от железа, для окисления двухвалентного железа в трехвалентное и последующее отделение гидроксида железа(III):
4 Fe 2+ + O2 + 2 H2O → 4 Fe3+ + 4 OH̅
Fe3+ + 3 H2O → Fe(OH)3 + 3 H+
Очистка восстановлением применяется в тех случаях, когда вода содержит легко восстанавливаемые вещества (соединения хрома, ртути, мышьяка). При этом их восстанавливают до более низкой степени окисления или металлов, а затем удаляют фильтрованием или флотацией.
Для восстановления Cr(VI) можно использовать металлическое железо или соли Fe(II). Наиболее хорошие результаты получают при рН = 2,5-3,0. Процесс восстановления протекает по реакции:
Cr2O72- + 6Fe2+ + 14 H+ = 2 Cr3+ + 6Fe3+ + 6 H2O
Для восстановления Cr(VI) можно также использовать SO2. Далее восстановленный хром осаждают известью:
2 Cr3+ + 3 Ca(OH)2 = 2 Cr(OH)3↓ + 3 Ca2+
Затем влажный осадок Cr(OH)3 прокаливают до образования Cr2O3, служащего источником получения хрома в промышленности:
2
Cr(OH)3↓
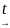 Cr2O3
+ 3H2O
Cr2O3
+ 3H2O
