
- •Раздел 1 Машины постоянного тока
- •Тема 1.1. Общие сведения о машинах постоянного тока
- •1.1.1. Основные сведения о машинах постоянного тока и их классификация
- •1.1.2. Принцип действия генератора и двигателя постоянного тока
- •1.1.3. Конструкция генератора и двигателя постоянного тока
- •1.1.4. Обмотки якоря машин постоянного тока
- •1.1.5. Электродвижущая сила (эдс) и электромагнитный момент машины постоянного тока
- •1.1.6. Выбор типа обмотки якоря
- •Тема 1.2. Магнитное поле машины постоянного тока
- •1.2.1. Магнитная цепь машины постоянного тока и реакция якоря
- •1.2.2. Способы возбуждения машин постоянного тока
- •Тема 1.3. Коммутация в машинах постоянного тока
- •1.3.1. Причины, вызывающие искрение на коллекторе
- •1.3.2. Виды коммутации и способы её улучшения
- •Тема 1.4. Коллекторные генераторы и двигатели постоянного тока
- •1.4.1. Виды генераторов постоянного тока и их характеристики
- •1.4.2. Параллельная работа генераторов постоянного тока
- •1.4.3. Коллекторные двигатели постоянного тока
- •1.4.4. Пуск и регулирование скорости вращения двигателя постоянного тока
- •1.4.5. Потери и кпд коллекторных машин постоянного тока
- •1.4.6. Машины постоянного тока специального назначения
- •Раздел 2. Трансформаторы
- •Тема 2.1. Назначение, классификация, принцип действия и устройство трансформаторов
- •2.1.1. Назначение, классификация и принцип действия трансформаторов
- •2.1.2.Устройство трансформаторов
- •2.1.3.Многообмоточные трансформаторы
- •Тема 2.2. Режимы работы трансформатора и его характеристики
- •2.2.1. Приведенный трансформатор
- •2.2.2. Режим холостого хода
- •2.2.3. Нагрузочный режим
- •2.2.4. Режим короткого замыкания
- •2.2.5. Потери и кпд трансформатора
- •2.2.6. Регулирование напряжения трансформаторов
- •Тема 2.3. Группы соединения обмоток и параллельная работа трансформаторов
- •2.3.1. Группы соединения обмоток
- •2.3.2. Параллельная работа трансформаторов
- •Тема 2.4 Автотрансформаторы и трансформаторы специального назначения
- •2.4.1. Автотрансформаторы
- •2.4.2. Трансформаторы специального назначения
- •Раздел 3. Машины переменного тока
- •Тема 3.1. Синхронные машины переменного тока
- •3.1.1. Назначение, принцип действия и устройство синхронных машин переменного тока
- •3.1.2. Возбуждение синхронных машин
- •3.1.3. Потери и кпд синхронных машин
- •Тема 3.2. Синхронные генераторы
- •3.2.1. Реакция якоря синхронного генератора
- •3.2.2. Характеристики синхронного генератора
- •3.2.3. Включение синхронных генераторов на параллельную работу
- •Тема 3.3 Синхронные двигатели и компенсаторы
- •3.3.1. Особенности конструкции синхронных двигателей
- •3.3.2. Пуск и регулирование скорости вращения синхронных двигателей
- •3.3.3. Рабочие характеристики синхронного двигателя
- •3.3.4. Синхронные компенсаторы
- •3.3.5. Синхронные машины специального назначения
- •Тема 3.4 Асинхронные машины
- •3.4.1. Назначение, конструкция, принцип действия и режимы работы асинхронной машины
- •3.4.2. Устройство асинхронных двигателей
- •3.4.3. Потери и кпд асинхронного двигателя
- •3.4.4. Характеристики асинхронного двигателя
- •3.4.5. Пуск и регулирование частоты вращения трёхфазных асинхронных двигателей
- •3.4.6. Однофазные и конденсаторные асинхронные двигатели
- •3.4.7 . Асинхронные машины специального назначения
- •Раздел 4. Химические преобразователи электрической энергии
- •Тема 4.1. Гальванические элементы
- •4.1.1. Электрический ток в жидких проводниках
- •4.1.2. Эдс в гальваническом элементе
- •4.1.3. Сухие гальванические элементы
- •Тема 4.2. Аккумуляторы
- •4.2.1. Принцип действия аккумуляторов
- •4.2.2. Кислотные аккумуляторы
- •4.2.3. Щёлочные аккумуляторы
- •4.2.4. Электрические характеристики аккумуляторов
- •Раздел 5. Нагревание и охлаждение электрических машин и трансформаторов
- •Тема 5.1. Нагревание электрических машин и трансформаторов
- •5. 1. 1. Закон нагревания электрических машин и трансформаторов
- •5.1.2. Номинальные режимы работы электрических машин
- •Тема 5.2. Охлаждение электрических машин и трансформаторов
- •5.2.1. Охлаждение электрических машин
- •5.2.2. Охлаждение трансформаторов
- •5.2.3. Новые принципы создания электрических машин
- •Литература
4.1.3. Сухие гальванические элементы
Промышленность выпускает гальванические элементы различных типов (с различными электродами и электролитами), имеющие разную конструкцию. Промышленность выпускает угольно-цинковые элементы, в которых угольный и цинковый электроды погружены в водный раствор хлористого аммония (нашатыря) или поваренной соли, а в качестве деполяризатора применяют перекись марганца. Наиболее распространены сухие гальванические элементы (рис. 63), применяемые в радиоприёмниках, в карманных электрофонарях и пр. В них жидкий электролит заменён тестообразной массой, состоящей из раствора нашатыря, смешанного с древесными опилками, а цинковый электрод выполнен в виде цилиндрической коробки, используемой в качестве сосуда, в котором помещают электролит и угольный электрод.
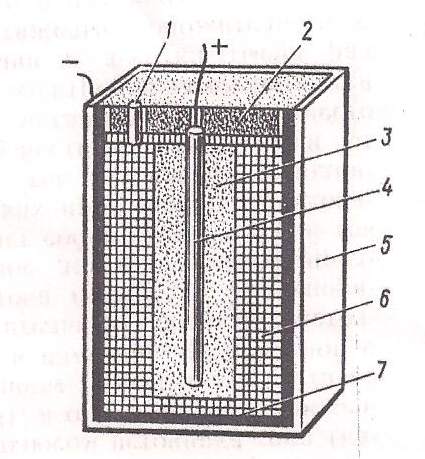
Рис. 63. Устройство сухого угольно цинкового гальванического элемента:
1 – газоотводная трубка; 2 – смоляная заливка; 3 – деполяризатор; 4 – угольный электрод; 5 – картонный футляр; 6 - тестообразная паста (сухой электролит); 7 – цинковый электрод.
Способность химических источников тока отдавать электрическую энергию характеризуется их ёмкостью. Ёмкость – количество электричества, запасённое в химическом источнике тока, измеряется в ампер-часах. Номинальная ёмкость химического источника тока равна произведению номинального (расчётного) разрядного тока (в амперах), отдаваемого им при подключении нагрузки, на время (в часах) до того момента, пока его не достигнет минимально допустимого значения. Ёмкость химических элементов постепенно уменьшается, даже если он не отдаёт электрической энергии (после 10÷12 месяцев хранения уменьшается на 20÷30%). Это объясняется непрерывным протеканием в них химических реакций и расходом при этом активных химических веществ.
Тема 4.2. Аккумуляторы
4.2.1. Принцип действия аккумуляторов
Аккумуляторы – химические источники тока, способные накапливать (аккумулировать) в себе электрическую энергию и по мере необходимости отдавать её во внешнюю цепь. Накапливание в аккумуляторе электрической энергии происходит при пропускании по нему тока от постороннего источника (заряд аккумулятора). Заряд сопровождается превращением электрической энергии в химическую, в результате чего аккумулятор сам становится источником электрического тока; при разряде происходит обратный процесс. Аккумуляторы обладают большим преимуществом по сравнению с гальваническими элементами: элемент после разряда приходит в полную негодность, а аккумулятор после разряда может быть снова заряжен и служить источником электроэнергии. В зависимости от рода электролита аккумуляторы разделяют на кислотные и щелочные.
4.2.2. Кислотные аккумуляторы
В кислотном аккумуляторе электродами являются свинцовые пластины, покрытые так называемыми активными массами, которые взаимодействуют с электролитом при электрохимических реакциях в процессе заряда и разряда. Активной массой положительного электрода (анода) служит перекись свинца PbO2, а активной массой отрицательного электрода (катода) – чистый (губчатый) свинец Pb. Электролитом является (25÷34) % раствор серной кислоты.
Пластины аккумулятора могут иметь конструкцию поверхностного или намазанного типа. Пластины поверхностного типа отливают из свинца: поверхность их, на которой происходят электрохимические реакции, увеличена благодаря наличию рёбер, борозд и т. п. Их применяют в стационарных аккумуляторных батареях и некоторых батареях пассажирских вагонов.
В аккумуляторных батареях тепловозов применяют пластины намазанного типа (рис. 64). Они имеют остов из сплава свинца с сурьмой, в котором устроен ряд ячеек, заполняемых пастой: для положительных пластин это порошок свинца Pb, а для отрицательных – порошок перекиси свинца PbO2, замешанные на водном растворе серной кислоты. Чтобы повысить пористость и уменьшить усадку активной массы в пасту добавляют графит, сажу, кремний, сернокислый барий и другие инертные материалы, называемые расширителями. Для предотвращения выпадания из пластин активной массы их ячейки после заполнения пастой закрывают свинцовыми листами с большим количеством отверстий, которые не препятствуют доступу к пластинам электролита. Намазанные пластины имеют большую поверхность соприкосновения с электролитом и хорошо им пропитываются, что способствует уменьшению массогабаритов аккумуляторов и позволяет получить при разряде большие токи. Для предотвращения замыкания пластин посторонними предметами (щупом для измерения уровня электролита, устройством для его заливки и др.) пластины в некоторых аккумуляторах покрывают поливинилхлоридной сеткой.
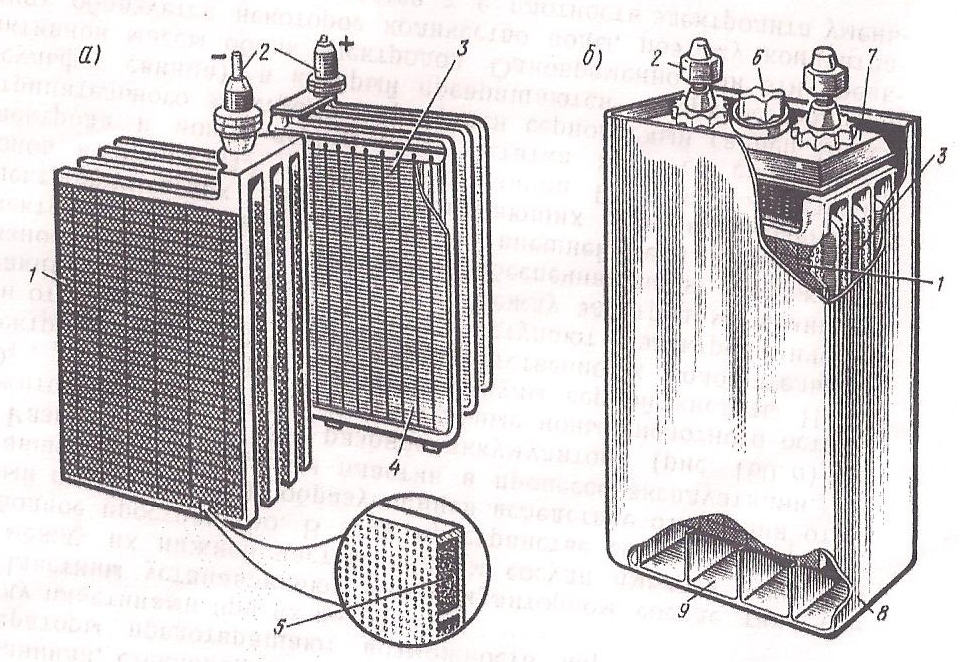
Рис. 64. Устройство пластин (а) и общий вид (б) кислотного аккумулятора:
1 – блок намазанных отрицательных пластин; 2 – выводные штыри; 3 – блок панцирных положительных пластин; 4 – панцирь; 5 – активная масса; 6 – отверстие с пробкой для залива электролита; 7 – крышка; 8 – эбонитовый сосуд; 9 – пространство для осаждения шлама.
Для увеличения ёмкости в каждый аккумулятор устанавливают несколько положительных и отрицательных пластин; одноимённые соединяют в общие блоки, к которым приваривают выводные штыри. Эти блоки обычно устанавливают в эбонитовом или пластмассовом корпусе так, чтобы между каждыми двумя пластинами одной полярности располагались пластины другой полярности. Пластины отделяют друг от друга сепараторами из поливинилхлорида, стекловойлока или другого изоляционного материала для предотвращения замыкания между ними.
При разряде аккумулятора положительные ионы водорода и отрицательные ионы кислотного остатка SO4ˉ, на которые распадаются молекулы серной кислоты H2SO4 электролита, направляются соответственно к положительному и отрицательному электродам и вступают в электрохимические реакции с активными массами. Между электродами возникает разность потенциалов около 2 В, обеспечивающая прохождение электрического тока при замыкании внешней цепи. В результате электрохимических реакций образуется сернокислый свинец PbSO4 (сульфат свинца), в который превращаются поверхностные слои активной массы обоих электродов, и некоторое количество воды, которая понижает концентрацию серной кислоты. Разряд обычно ведут до того момента, когда в сернокислый свинец перейдёт около 35 % активной массы.
Заряд разряженного аккумулятора проводят, присоединяя его к источнику постоянного тока с напряжением большим напряжения аккумулятора. При заряде положительные ионы водорода перемещаются к отрицательному электроду, а отрицательные ионы сернокислого остатка SO4ˉ - к положительному электроду и вступают в химическое взаимодействие с сульфатом свинца PbSO4, покрывающим оба электрода. В результате сульфат свинца PbSO4 растворяется и на электродах вновь образуются активные массы: перекись свинца PbO2 на положительном электроде и губчатый свинец Pb – на отрицательном. Электрохимические реакции при разряде и заряде аккумулятора могут быть выражены уравнением
PbO2 + Pb + H2SO4 ←заряд - разряд→ 2PbSO4 + 2H2O.
Читая это уравнение слева направо, получаем процесс разряда, справа налево – процесс заряда. Полностью заряженный аккумулятор имеет ЭДС около 2,2 В. При разряде напряжение довольно быстро падает до 2 В, а затем медленно понижается до (1,8÷1,7) В (рис. 65), при этом напряжении разряд прекращают во избежание повреждения аккумулятора. Если разряженный аккумулятор оставить на некоторое время в бездействии, то напряжение его снова восстановится до 2 В («отдых»).
При заряде напряжение аккумулятора быстро поднимается до 2,2 В, а затем медленно повышается до 2,3 В и, наконец, снова довольно быстро возрастает до (2,6÷2,7) В. Неработающие аккумуляторные батареи необходимо периодически подзаряжать, т. к. в них происходит саморазряд (потеря ёмкости). При неправильной эксплуатации аккумуляторов [разряд ниже (1,8÷1,7) В, систематический недозаряд, понижение уровня и плотности электролита] происходит повреждение их пластин, называемое сульфатацией. Сульфатация – переход мелкокристаллического сульфата свинца, покрывающего пластины при разряде, в нерастворимые крупнокристаллические соединения, которые при заряде не переходят в перекись свинца PbO2 и свинец Pb. При этом аккумулятор становится непригодным для эксплуатации.
При заряде напряжение аккумулятора быстро поднимается до 2,2 В, а затем медленно повышается до 2,3 В и, наконец, снова довольно быстро возрастает до (2,6÷2,7) В. Неработающие аккумуляторные батареи необходимо периодически подзаряжать, т. к. в них происходит саморазряд (потеря ёмкости). При неправильной эксплуатации аккумуляторов [разряд ниже (1,8÷1,7) В, систематический недозаряд, понижение уровня и плотности электролита] происходит повреждение их пластин, называемое сульфатацией. Сульфатация – переход мелкокристаллического сульфата свинца, покрывающего пластины при разряде, в нерастворимые крупнокристаллические соединения, которые при заряде не переходят в перекись свинца PbO2 и свинец Pb. При этом аккумулятор становится непригодным для эксплуатации.
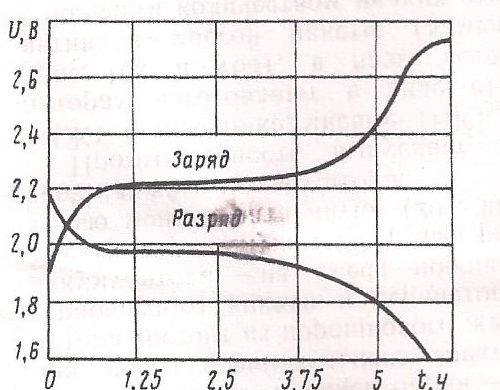
Рис. 65. Кривые напряжения кислотного аккумулятора при заряде и разряде.
Кислотные аккумуляторы применяют только на тепловозах. Тепловозная аккумуляторная батарея 32ТН-450 состоит из32 последовательно соединённых аккумуляторов ёмкостью 450 А×ч [Т – тепловозная; Н – тип положительных пластин (намазанные)].
