
- •Раздел 1 Машины постоянного тока
- •Тема 1.1. Общие сведения о машинах постоянного тока
- •1.1.1. Основные сведения о машинах постоянного тока и их классификация
- •1.1.2. Принцип действия генератора и двигателя постоянного тока
- •1.1.3. Конструкция генератора и двигателя постоянного тока
- •1.1.4. Обмотки якоря машин постоянного тока
- •1.1.5. Электродвижущая сила (эдс) и электромагнитный момент машины постоянного тока
- •1.1.6. Выбор типа обмотки якоря
- •Тема 1.2. Магнитное поле машины постоянного тока
- •1.2.1. Магнитная цепь машины постоянного тока и реакция якоря
- •1.2.2. Способы возбуждения машин постоянного тока
- •Тема 1.3. Коммутация в машинах постоянного тока
- •1.3.1. Причины, вызывающие искрение на коллекторе
- •1.3.2. Виды коммутации и способы её улучшения
- •Тема 1.4. Коллекторные генераторы и двигатели постоянного тока
- •1.4.1. Виды генераторов постоянного тока и их характеристики
- •1.4.2. Параллельная работа генераторов постоянного тока
- •1.4.3. Коллекторные двигатели постоянного тока
- •1.4.4. Пуск и регулирование скорости вращения двигателя постоянного тока
- •1.4.5. Потери и кпд коллекторных машин постоянного тока
- •1.4.6. Машины постоянного тока специального назначения
- •Раздел 2. Трансформаторы
- •Тема 2.1. Назначение, классификация, принцип действия и устройство трансформаторов
- •2.1.1. Назначение, классификация и принцип действия трансформаторов
- •2.1.2.Устройство трансформаторов
- •2.1.3.Многообмоточные трансформаторы
- •Тема 2.2. Режимы работы трансформатора и его характеристики
- •2.2.1. Приведенный трансформатор
- •2.2.2. Режим холостого хода
- •2.2.3. Нагрузочный режим
- •2.2.4. Режим короткого замыкания
- •2.2.5. Потери и кпд трансформатора
- •2.2.6. Регулирование напряжения трансформаторов
- •Тема 2.3. Группы соединения обмоток и параллельная работа трансформаторов
- •2.3.1. Группы соединения обмоток
- •2.3.2. Параллельная работа трансформаторов
- •Тема 2.4 Автотрансформаторы и трансформаторы специального назначения
- •2.4.1. Автотрансформаторы
- •2.4.2. Трансформаторы специального назначения
- •Раздел 3. Машины переменного тока
- •Тема 3.1. Синхронные машины переменного тока
- •3.1.1. Назначение, принцип действия и устройство синхронных машин переменного тока
- •3.1.2. Возбуждение синхронных машин
- •3.1.3. Потери и кпд синхронных машин
- •Тема 3.2. Синхронные генераторы
- •3.2.1. Реакция якоря синхронного генератора
- •3.2.2. Характеристики синхронного генератора
- •3.2.3. Включение синхронных генераторов на параллельную работу
- •Тема 3.3 Синхронные двигатели и компенсаторы
- •3.3.1. Особенности конструкции синхронных двигателей
- •3.3.2. Пуск и регулирование скорости вращения синхронных двигателей
- •3.3.3. Рабочие характеристики синхронного двигателя
- •3.3.4. Синхронные компенсаторы
- •3.3.5. Синхронные машины специального назначения
- •Тема 3.4 Асинхронные машины
- •3.4.1. Назначение, конструкция, принцип действия и режимы работы асинхронной машины
- •3.4.2. Устройство асинхронных двигателей
- •3.4.3. Потери и кпд асинхронного двигателя
- •3.4.4. Характеристики асинхронного двигателя
- •3.4.5. Пуск и регулирование частоты вращения трёхфазных асинхронных двигателей
- •3.4.6. Однофазные и конденсаторные асинхронные двигатели
- •3.4.7 . Асинхронные машины специального назначения
- •Раздел 4. Химические преобразователи электрической энергии
- •Тема 4.1. Гальванические элементы
- •4.1.1. Электрический ток в жидких проводниках
- •4.1.2. Эдс в гальваническом элементе
- •4.1.3. Сухие гальванические элементы
- •Тема 4.2. Аккумуляторы
- •4.2.1. Принцип действия аккумуляторов
- •4.2.2. Кислотные аккумуляторы
- •4.2.3. Щёлочные аккумуляторы
- •4.2.4. Электрические характеристики аккумуляторов
- •Раздел 5. Нагревание и охлаждение электрических машин и трансформаторов
- •Тема 5.1. Нагревание электрических машин и трансформаторов
- •5. 1. 1. Закон нагревания электрических машин и трансформаторов
- •5.1.2. Номинальные режимы работы электрических машин
- •Тема 5.2. Охлаждение электрических машин и трансформаторов
- •5.2.1. Охлаждение электрических машин
- •5.2.2. Охлаждение трансформаторов
- •5.2.3. Новые принципы создания электрических машин
- •Литература
Раздел 4. Химические преобразователи электрической энергии
Тема 4.1. Гальванические элементы
4.1.1. Электрический ток в жидких проводниках
Преобразователи электрической энергии – это, в основном, химические источники электрической энергии, преобразующие энергию химических реакций в электрическую. К ним относятся гальванические элементы и аккумуляторы.
В жидких проводниках (электролитах) происходит процесс электролитической диссоциации, т. е. непрерывный самопроизвольный распад молекул на составные части. Например, при растворении медного купороса CuSO4 в воде, его молекулы распадаются на положительные ионы меди Cu и отрицательные ионы SO4 (кислотный остаток). В электролите происходит беспорядочное движение ионов и в целом такой раствор является электрически нейтральным, т. к. в нём содержится одинаковое количество положительно и отрицательно заряженных ионов. Однако если жидкий проводник, например раствор медного купороса, поместить в электрическое поле (рис. 61), созданное при помощи двух электродов (заряженных медных пластин), то на положительные и отрицательные ионы начнут действовать электрические силы.
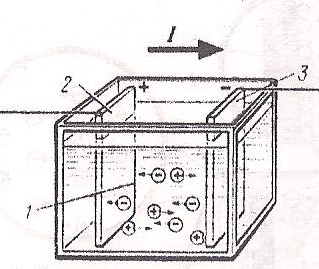
- отрицательный ион (SO4)
+ положительный ион (Cu)
Рис.61. Схема прохождения электрического тока через электролит:
1 – электролит; 2 – анод; 3 – катод.
При этом положительные ионы меди Cu устремятся к отрицательному катоду, а отрицательно заряженные ионы кислотного остатка SO4 – к положительному аноду. Это упорядоченное движение ионов представляет собой электрический ток в жидких проводниках. Следовательно, ток в жидких проводниках существенно отличается от тока в металлах, т. к. вместо лёгких электронов здесь движутся в тысячи и десятки тысяч раз более тяжёлые положительные и отрицательные ионы.
4.1.2. Эдс в гальваническом элементе
Простейший
медно-цинковый гальванический элемент
Вольта состоит из двух пластин
(электродов): цинковой (катода) и медной
(анода), опущенных в электролит,
представляющий собой водный раствор
серной кислоты H2SO4
(рис. 62). При растворении серной кислоты
в воде происходит процесс электролитической
диссоциации, т. е. часть молекул кислоты
распадается на положительные ионы
водорода
 и отрицательные ионы кислотного остатка
SO4ˉ.
Одновременно происходит растворение
цинкового электрода в серной кислоте,
при этом положительные ионы цинка
и отрицательные ионы кислотного остатка
SO4ˉ.
Одновременно происходит растворение
цинкового электрода в серной кислоте,
при этом положительные ионы цинка
 переходят в раствор и соединяются с
отрицательными ионами SO4ˉ
кислотного остатка, образуя нейтральные
молекулы сернокислого цинка
переходят в раствор и соединяются с
отрицательными ионами SO4ˉ
кислотного остатка, образуя нейтральные
молекулы сернокислого цинка ZnSO4.
При этом на цинковом электроде будут
скапливаться оставшиеся свободные
электроны, вследствие чего он приобретёт
отрицательный заряд. В электролите же
образуется положительный заряд и медный
электрод, практически не растворяясь
в электролите, приобретёт положительный
заряд, т. е. тот же, что и электролит.
ZnSO4.
При этом на цинковом электроде будут
скапливаться оставшиеся свободные
электроны, вследствие чего он приобретёт
отрицательный заряд. В электролите же
образуется положительный заряд и медный
электрод, практически не растворяясь
в электролите, приобретёт положительный
заряд, т. е. тот же, что и электролит.
ЭДС, создаваемая гальваническим элементом, зависит от химических свойств электролита и материалов, из которых выполнены электроды. Обычно подбирают такие комбинации материалов, при которых ЭДС во всех применяемых элементах не превышает (1,1÷1,5) В. При подключении к электродам гальванического элемента какого-либо приёмника электроэнергии по внешней цепи начнёт протекать электрический ток от медного электрода (положительный полюс элемента) к цинковому (отрицательный полюс элемента). В электролите в это время начнётся движение положительных ионов цинка и водорода от медного электрода к цинковому. В результате с цинкового электрода (катода) в электролит снова начнут поступать положительные ионы цинка, поддерживая на нём отрицательный заряд; на медном же электроде (аноде) будут осаждаться новые положительные ионы. Т. о., между анодом и катодом всё время будет существовать разность потенциалов, необходимая для прохождения тока по электрической цепи.
Рассмотренный гальванический элемент Вольта не может длительно работать вследствие возникающего в нём вредного явления поляризации, сущность которого состоит в том, что положительные электроны водорода , направляющиеся к медному электроду, взаимодействуют с имеющимися на нём свободными электронами и превращаются в нейтральные атомы водорода.
Эти атомы покрывают поверхность медного электрода сплошным слоем, ухудшая работу гальванического элемента за счёт изоляции медного электрода от электролита и создания дополнительной ЭДС поляризации между слоем водорода и электролитом, направленной против основной ЭДС и уменьшающей её.
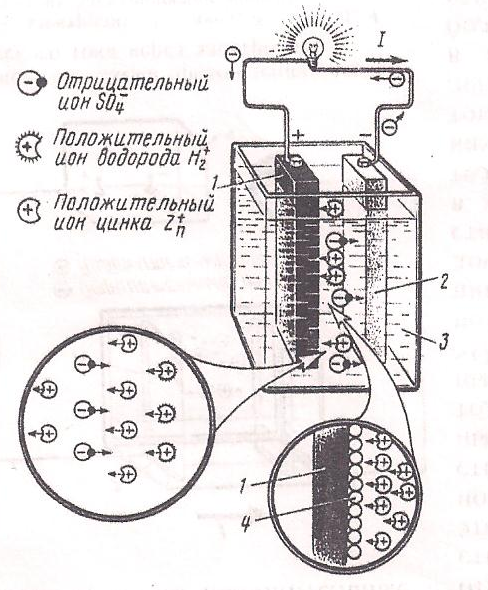
Рис. 62. Устройство медно-цинкового гальванического элемента.
. Для борьбы с поляризацией во всех гальванических элементах вокруг положительного электрода располагают специальные вещества – деполяризаторы, легко вступающие в химическую реакцию с водородом и поглощающие его.
