
§ V1.4. Давление насыщенного пара компоненте над раствором. Уравнения Рауля и Генри. Растворимость газов
Установим зависимость давления насыщенного пара растворителя и растворенного вещества от состава раствора и свойств чистых компонентов для идеальных, предельно разбавленных и неидеальных растворов. Для этого воспользуемся общей зависимостью давления насыщенного пара компонента раствора от химического потенциала и выразим в ней химический потенциал через состав для разных типов растворов.
Идеальные растворы. Подставляя в уравнения (VI. 18) выражения для химического потенциала компонента идеального раствора из (VI.43) или (VI.45), получаем
(VI.51)
Интегрируя (VI.51) в пределах от р* до р , и от х = 1 до находим
(VI.52)
отсюда (VI.53)
(VI.54)
где р* — давление пара над жидким растворителем; р — давление пара над (чистым) жидким растворенным веществом. Выражения (VI.53) и (VI.54) называются законом Рауля или уравнениями Рауля. Равновесное парциальное давление пара компонента в идеальном растворе пропорционально молярной доле этого компонента в растворе. Зависимость парциального давления пара компонента от состава имеет вид прямой (рис. VI.2,a). Для твердого растворенного вещества p в уравнении (VI.54) представляет собой давление насыщенного пара над переохлажденной жидкостью при той же температуре (точка А', рис. VI.2,6). Уравнение Рауля позволяет установить зависимость давления пара над чистым твердым растворенным веществом от его растворимости в идеальном растворе. В насыщенном идеальном растворе парциальное давление пара растворенного вещества над раствором р2нас равно давлению насыщенною пара над твердым веществом р (т). При этом из уравнения Рауля получаем (рис. VL2,a)
(VI.55)
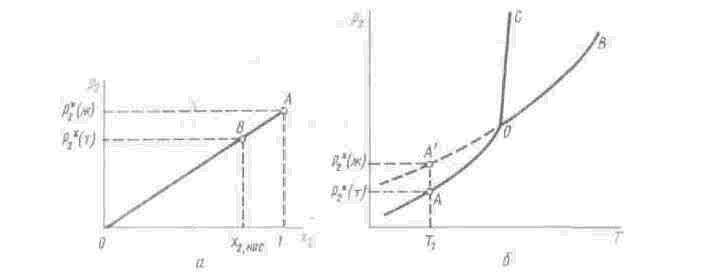
Рис. V1.2. Зависимость парциального давления пара растворенною вещества от ею молярной доли (а) и температуры (б) для идеальною pacтвopa
где Х2нас — растворимость вещества в идеальном растворе, молярные доли. Из рис. V1.2, а видно, что справедливым будет соотношение
откуда и получается уравнение (VI.55).
Предельно разбавленные растворы. В предельно разбавленном растворе уравнение Рауля применимо к растворителю. По этому уравнению можно определить молекулярную массу М2 нелетучего растворенного вещества, если известно давление пара растворителя над разбавленным раствором. Преобразуя уравнение (VI.53) следующим образом:
Имеем
(VI.56)
где p /p* — относительное понижение давления пара растворителя над раствором; оно равно молярной доле растворенного вещества. Учитывая, что
получаем из уравнения (VI.56) выражение для определения молекулярной массы растворенного вещества
где М — молекулярная масса растворителя; — масса растворителя; — масса растворенного вещества. К растворенному веществу в предельно разбавленном растворе формула Рауля не применима (см. § VI.3). Однако из уравнения Гиббса — Дюгема для химического потенциала (VI.14) можно вывести зависимость парциального давления пара растворенного вещества над предельно разбавленным раствором от состава раствора. Подставляя в уравнение (VI. 14) значения d и d из (VI.43) и (VI.19), получаем
Учитывая, что и , преобразуем правую часть уравнения (VI.58)
и получаем (VI.59)
После интегрирования (VI.59) получим
где In К — постоянная интегрирования, откуда р2 = К . (VI.60)
Выражение (VI.60) называется законом или уравнением Генри. Из закона Генри следует, что парциальное давление пара растворенного вещества над предельно разбавленным раствором пропорционально молярной доле растворенного вещества в этом растворе. Постоянная Генри К определяется экстраполяцией опытных данных:
Растворимость газов. Уравнение Генри (VI.60) имеет большое практическое значение для изучения растворимости газов в растворах. Если растворенное вещество — газ, то х2 в уравнении (VI.60) представляет собой растворимость газа в растворе при давлении р2. Из уравнения Генри следует, что в предельно разбавленных растворах растворимость газов пропорциональна их парциальному давлению над раствором. Из (VI.60) получаем
где х — молярная доля растворенного газа; 1/К2 — константа, зависящая от температуры; р2 —давление газа над раствором. На практике количество растворенною газа принято выражать не в молярных долях, а в объемных единицах. Если объем газа измеряется при температуре опыта, то уравнение Генри имеет вид
(V1.61)
где Краст — коэффициент растворимости. Таким образом, коэффициент растворимости — это объем газа (измеренный при температуре опыта), который растворяется при данной температуре в единице объема растворителя при парциальном давлении газа, равном единице (1 МПа). Если объем газа измеряется при температуре 273 К, то видоизмененное уравнение Генри имеет вид
(VI .62)
где Кпогл — коэффициент поглощения газа. Он представляет собой объем газа (измеренный при 273 К), который растворяется в единице объема растворителя при парциальном давлении газа р2, равном единице (1 МПа). Между этими коэффициентами имеется простое соотношение, которое получается, если разделить уравнение (VI.61) на (VI.62), полагая р2 одинаковыми (p2 = const): Краст/Кпогл = Vт/Vo. Принимая, что газ подчиняется законам идеального газа и, в частности, закону Гей-Люссака (Vт/Vо = Т/273), получим искомое соотношение
Растворимость газов в водных растворах электролитов определяется по эмпирическому уравнению И. М. Сеченова
=Кс, где S0 — растворимость газа в воде; S — растворимость газа в растворе электролита; К—коэффициент; с—концентрация электролита в растворе. Растворимость газа в воде всегда больше растворимости его в растворе электролита.
Неидеальные растворы. Для неидеальных растворов в уравнение (VI. 19) нужно подставить выражение для химического потенциала (VI.49) или (VI.50), тогда
ln p =d ln a (VI.63) После интегрирования получим
где In К, — постоянная интегрирования. Для растворителя и растворенного вещества получим соответственно
(VI.64) Если оба компонента — взаимно растворимые жидкости, то за стандартное состояние выбирают чистое вещество. При этом уравнения для давления пара над раствором имеют вид
