Лекции / ФОМ. Лекции / lection / lec_19
.rtf
ЭЛЕКТРОДНЫЕ ПРОЦЕССЫ И ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ
При рассмотрении электродных процессов мы будем широко пользоваться величиной разности электрических потенциалов, сокращенно называя ее просто разностью потенциалов. Электрический потенциал, отвечающий данной точке тела, как известно, равен работе, совершаемой силами электрического поля при перемещении единицы положительного электричества из рассматриваемой точки в точку, потенциал которой принят равным нулю. Разность потенциалов, отвечающих двум точкам, равна работе переноса заряда от одной точки к другой.
К электродным процессам относятся две группы процессов, тесно связанные между собой. Во-первых, процессы возникновения разности потенциалов и, следовательно, электрического тока в результате протекания химической реакции, например в гальванических элементах. Во-вторых, обратные им химические процессы, совершающиеся при электролизе, которые возникают при пропускании электрического тока через раствор и связаны с переходом тока с проводника одного рода в проводник другого рода.
Эти две группы процессов во многих случаях являются взаимно обратимыми. Хорошо известный свинцовый аккумулятор может служить примером такой обратимости. При зарядке его с помощью внешнего источника тока осуществляется химическая реакция, которая при использовании заряженного аккумулятора в качестве источника тока протекает в обратном направлении и поддерживает необходимую разность потенциалов на электродах.
Еще М. В. Ломоносов отмечал связь между электрическими явлениями и химическими процессами. Опыты Гальвани положили начало изучению электродвижущих сил; А. Вольта, В. В. Петров, Б. С. Якоби разрабатывали методы получения постоянных источников тока; Фарадеем были открыты основные количественные законы электролиза.
Вольта установил (1800), что на границе соприкосновения двух металлов возникает разность потенциалов; она получила название контактной разности потенциалов. До недавнего времени контактная разность потенциалов между металлами считалась очень малой и при рассмотрении гальванических элементов обычно не учитывалась. Однако развитие методов эксперимента привело к получению новых данных, показавших, что она отнюдь не так мала и может достигать нескольких вольт.
Контактная разность потенциалов между двумя металлами зависит от соотношения в способности их отделять электроны и равна разности работ выхода электрона.
Электродвижущие силы.
Электродные процессы как в гальванических элементах, так и при электролизе всегда связаны с изменением заряда атомов (ионов) или атомных групп, т. е. представляют собой окислительно-восстановительные реакции. Для получения электрического тока необходимо провести окислительно-восстановительную реакцию в такой форме, чтобы процессы окисления и восстановления происходили раздельно (на разных электродах) и в результате этого электроды переводились бы в такие состояния, при которых электрические потенциалы их были различны.
Представим себе, что пластинка какого-нибудь металла, например железа, опущена в воду. Ионы железа в результате действия сильно полярных молекул воды, отрываясь от металла, начинают переходить в слой воды, прилегающий к поверхности пластинки. Возникающее вследствие этого электростатическое притяжение между ионами, перешедшими в раствор, и противоположно заряженной пластинкой металла препятствует дальнейшему течению этого процесса, и в системе устанавливается равновесие. Возникает некоторая разность потенциалов между металлом и окружающей водной средой. В соответствии с неодинаковой способностью различных металлов к выделению ионов в окружающую среду и неодинаковой способностью их к гидратации равновесие это отвечает различной разности потенциалов и соответственно разной концентрации ионов в растворе. Положение равновесия зависит в первую очередь от соотношения между количеством энергии, необходимой для отрыва иона от металла (работа выхода иона), и количеством энергии, выделяющейся при гидратации иона.
Подобное взаимодействие происходит при погружении металла не только в чистую воду, но и в раствор. Рассмотрим для простоты равновесие между металлом и раствором какой-нибудь соли того же металла. Повышение концентрации ионов данного металла в растворе, очевидно, облегчает процесс перехода ионов из раствора в металл, и, следовательно, равновесие установится при другом потенциале заряда металла. Металлы, ионы которых обладают значительной способностью к переходу в раствор, будут заряжаться и в таком растворе отрицательно, но в меньшей степени, чем в чистой воде. А металлы, ионы которых обладают слабой способностью к такому растворению, будут заряжаться при этом даже положительно вследствие того, что имеющиеся в растворе положительные ионы выделяются на металле первоначально с большей скоростью, чем происходит переход ионов из металла в раствор.
Электрическое поле, создаваемое зарядом металла в окружающем его растворе, вызывает неравномерное распределение ионов в растворе вблизи металла. Если металл заряжен отрицательно (рис. 146), то катионы, находящиеся в растворе вблизи него, притягиваясь металлом, концентрируются около него, в особенности в слое, непосредственно прилегающем к поверхности металла. Анионы же отталкиваются металлом, и их концентрация в растворе вблизи металла будет понижена, в особенности в слое, непосредственно прилегающем к поверхности металла. В результате раствор вблизи металла приобретает заряд, противоположный по знаку заряду металла. Образуется двойной электрический слой. Этот слой характеризуется различным распределением ионов разного знака в поверхностном слое раствора и неодинаковым распределением зарядов в поверхностном слое металла. Он связан с определенной разностью потенциалов (скачком потенциала) на поверхности раздела металл/раствор.
Толщина этого слоя в растворе зависит от концентрации раствора, от заряда металла и от температуры. Она может различаться в довольно широких пределах (от нескольких ангстрем до микрона). Слой этот в растворе обладает диффузным строением, т. е. избыточная концентрация катионов и недостаток анионов постепенно убывают по мере удаления от поверхности металла, так как взаимное отталкивание катионов и их тепловое движение противодействуют повышению их концентрации под действием электрического поля раствора. Этот слой в растворе часто называют диффузным слоем.
|
|
Рис. 146. Двойной электрический слой.
|
Очевидно, если металл при погружении в раствор заряжается положительно, то в диффузном слое концентрация катионов будет понижена, а анионов —повышена по сравнению с концентрацией их в растворе. Кроме указанного различия в концентрациях анионов и катионов, на образование двойного электрического слоя могут оказывать влияние и другие эффекты: например, случай, когда на поверхности электрода могут адсорбироваться молекулы растворителя и ионы или молекулы растворенных веществ.
Таким образом, при погружении, металла в воду или в раствор, содержащий ионы данного металла, на поверхности раздела металл/раствор образуется двойной электрический слой и возникает разность потенциалов (скачок потенциала) между металлом и раствором. Величина этой разности потенциалов зависит от свойств металла и раствора, в особенности от концентрации ионов данного металла в растворе и от характера взаимодействия между частицами в двойном электрическом слое.
Гальванические элементы.
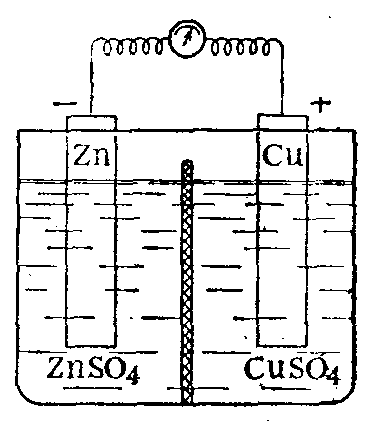
Рассмотрим систему, в которой не один, а два каких-нибудь металла, например цинк и медь, в виде пластинок опущены в растворы своих солей, разделенные диафрагмой (рис.147). Каждый из металлов может выделить в раствор то количество ионов, которое отвечает равновесию его с раствором. Однако отвечающие такому равновесию потенциалы этих металлов неодинаковы. Цинк обладает более высокой способностью выделять ионы в раствор, чем медь, и поэтому приобретает более высокий отрицательный заряд.
|
|
Рис. 147. Схема гальванического элемента.
|
Если пластинки соединить проволокой, то разница этих потенциалов пластинок и образование контактной разности потенциалов металлов Zn/Cu приводят к переходу соответствующего числа электронов с цинковой пластинки на медную. Это нарушает равновесие двойного слоя на обеих пластинках, и с цинковой пластинки выделится вновь некоторое число ионов Zn2+ в раствор, а на медной пластинке разрядится соответствующее число ионов Сu2+. Таким образом, снова возникает разность в зарядах пластинок, вызывающая переход электронов с цинковой пластинки на медную и дальнейшее течение описанных переходов ионов. В результате возникает самопроизвольно протекающий процесс, при котором цинковая пластинка растворяется, а на медной разряжаются ионы Сu2+ и выделяется металлическая медь. Переход электронов по проволоке от цинковой пластинки к медной дает электрический ток. Помещая на пути его электроизмерительные приборы, можно этот ток количественно характеризовать. Его можно использовать для проведения тех или иных процессов. С другой стороны, включая в цепь сопротивление, можно затормозить процесс или полностью остановить его. Включив равную по величине, но противоположно направленную разность потенциалов для того, чтобы процесс протекал в практически обратимых условиях, можно определить максимальную работу процесса и условия равновесия.
Гальванический элемент, основанный на описанном процессе, может служить источником получения электрического тока. Такие элементы были предложены в середине прошлого века Даниелем, Б. С. Якоби и др. Известно большое число гальванических элементов подобного рода.
Гальваническим элементом называется любое устройство, дающее возможность получать электрический ток за счет проведения той или иной химической реакции. Разность потенциалов между электродами элемента несколько зависит от условий, в которых она определяется. Работа, получаемая при изотермическом проведении какой-нибудь данной химической реакции, является наибольшей в том случае, когда реакция проводится в условиях, наиболее близких к обратимым. Так и электрическая работа, получаемая с помощью гальванического элемента, будет наибольшей, когда элемент работает в условиях, наиболее близких к обратимым. В этих условиях разность потенциалов между электродами элемента максимальна. Наибольшая разность потенциалов данного элемента (т. е. разность потенциалов при обратимых условиях его работы) называется его электродвижущей силой и обозначается э. д. с. Гальванической цепью мы будем называть последовательную совокупность всех скачков потенциала на различных поверхностях раздела, отвечающих данному гальваническому элементу.
В основе всякой гальванической цепи лежит окислительно-восстановительная реакция, проводимая так, что на одном из электродов (отрицательном) происходит окисление (в элементе Якоби – растворение цинка), а на другом (положительном) – восстановление (в элементе Якоби – выделение меди).
Так, в основе работы элемента Якоби лежит реакция
Zn + Сu2+ = Zn2+ + Сu или Zn+ CuSO4 = ZnSO4 + Сu
Эта реакция в обычных условиях может протекать самопроизвольно. Последнее видно, например, по вытеснению металлическим цинком меди из раствора сульфата меди. В этом случае электроны переходят непосредственно от атомов цинка к ионам меди. При таком взаимодействии процесс необратим и работа, которая могла бы совершаться за счет этой реакции, не используется. Проводя же указанную реакцию в гальваническом элементе, мы разделяем процессы окисления и восстановления, осуществляя их на различных электродах.
Окисление цинка Zn = Zn2+ + 2е- происходит на отрицательном электроде, восстановление меди Cu2+ + 2е- == Си на положительном.
Э. д. с. всякого работающего или способного к работе элемента является величиной существенно положительной. Однако в теории гальванических элементов возникает необходимость рассматривать реакции, лежащие в основе работы элемента, как реакции обратимые, т. е. способные совершаться в прямом и в обратном направлениях. В связи с этим вводится условие о знаках э. д. с. гальванических цепей.
Естественно принять положительный знак для э. д. с. нормально работающего (или способного работать) элемента, т. е. для того направления реакции, в котором она протекает (или может протекать) самопроизвольно, будучи способной совершать работу. Э. д. с. гальванической цепи, записанной для обратного направления этой реакции, приписывается отрицательный знак. Он показывает, что элемент может работать, лишь когда данная реакция осуществляется в направлении, противоположном указанному в записи цепи. При этом он будет обладать той же величиной э. д. с., но знаки заряда электродов будут обратными. Течение же реакции в направлении, указываемом записью цепи, в этом случае не только не может служить источником работы гальванического элемента, но, наоборот, требует затраты работы извне, т. е. требует приложения э. д. с. извне и может осуществляться путем электролиза.
Э. д. с. гальванического элемента, т. е. наибольшая разность потенциалов между электродами его, равна алгебраической сумме отдельных разностей (скачков) потенциала, существующих на поверхностях раздела между различными фазами, образующими элемент.
Условимся относительно формы записи гальванических цепей. Указанный выше элемент Якоби состоит из двух электродов — медного и цинкового, опущенных соответственно в растворы сульфатов меди и цинка. Эту цепь мы будем записывать следующим образом:
(-)Сu | Zn | ZnSO4 | CuSO4 Сu (+) С (1)
Все фазы, составляющие элемент, записываются подряд в одну строку и отмечаются все имеющиеся поверхности раздела между ними. Чтобы правильно отразить наличие контактной разности потенциалов, принято при записи на обоих концах цепи указывать одинаковые металлы. Пк, П_, П+, Пд — разности потенциалов, отвечающие имеющимся поверхностям раздела. Здесь Пк — контактная разность потенциалов, называемая в теории гальванических элементов большей частью просто контактным потенциалом; Пд — небольшая разность потенциалов, устанавливающаяся на поверхности соприкосновения двух растворов, различающихся по виду растворенного электролита или по концентрации, и называемая диффузионной разностью потенциалов или просто диффузионным потенциалом. Разности потенциалов между электродом и раствором П_ и П+ мы будем называть разностями потенциалов, отвечающими этим электродам (не смешивать с электродными потенциалами, рассматриваемыми в § 175).
Обычно принято записывать цепи так, чтобы отрицательный электрод располагался слева, а положительный справа. Считая э. д. с. элемента положительной, мы в соответствии с этим и все отдельные разности потенциалов —+ будем считать положительными, а скачки потенциалов +|— будем считать отрицательными. Часто применяют обратную систему записи или устанавливают какую-нибудь другую систему.
По существу это конечно, безразлично и необходимо только выдерживать одну систему знаков и записи для всех элементов. Электродвижущая сила цепи (XIII, 1) равна
Е = П+ + П_ + Пк +Пд . (2)
Обратимые и необратимые цепи.
Общие термодинамические условия обратимости применительно к работе гальванических элементов могут быть сформулированы следующим образом. Гальванический элемент работает обратимо при соблюдении двух условий: 1) если его э. д. с. лишь на бесконечно малую величину превышает приложенную к нему извне и противоположно направленную э. д. с. (обратимость условий работы) и 2) если реакция в элементе может быть полностью обращена в противоположном направлении при приложении к нему извне противоположно направленной э. д. с., которая лишь на бесконечно малую величину превышает э. д. с. данного элемента (обратимость самой цепи, т. е. химических реакций, происходящих на электродах).
Следует четко различать необратимость работы данного элемента, вызываемую лишь условиями работы элемента (при принципиальной обратимости самой цепи), и необратимость самой цепи.
Цепь (1) является обратимой, так как она удовлетворяет второму условию. Если к ней приложить противоположно направленную э. д. с., превышающую э. д. с. элемента, то будет происходить электролиз, при котором на одном электроде будет выделяться цинк из раствора, а на втором — растворяться медный электрод, т. е. будут происходить процессы, обратные протекающим при нормальной работе этого элемента.(Здесь можно пренебречь незначительной необратимостью, вызываемой переходом ионов из одного раствора в другой).
Примером необратимой цепи может служить цепь, отличающаяся от рассмотренной тем, что оба электрода погружены в раствор сульфата меди. В этом случае химическая реакция, совершающаяся при работе элемента, остается той же, но при приложении обратно направленной э. д. с., превышающей э. д. с. элемента, на левом электроде будет происходить выделение меди, а не цинка, т. е. будет протекать процесс, не являющийся обратным тому, который происходит при работе элемента.
В дальнейшем будут рассматриваться лишь обратимые цепи и работы элемента только в обратимых условиях.
Электродные потенциалы и э. д. с. гальванических элементов.
Гальванический элемент состоит из двух полуэлементов, каждый из которых содержит по одному электроду. Из таких полуэлементов можно составить самые различные гальванические элементы. К сожалению, в настоящее время еще не разработаны ни экспериментальные, ни теоретические методы надежного определения разностей потенциалов, соответствующих отдельным электродам. Можно точно определять только ЭДС цепи, т. е. алгебраическую сумму двух таких разностей потенциалов, контактного и диффузионного потенциалов, как следует из уравнения (2).
Однако в большинстве случаев для практических целей достаточно иметь условные величины, характеризующие потенциалы различных электродов по отношению к потенциалу какого-нибудь электрода, выбранного за стандарт. Зная эти величины для двух полуэлементов, можно определить ЭДС составленной из них цепи. Ограничимся в дальнейшем рассмотрением только водных растворов электролитов.
В настоящее время в качестве такого электрода сравнения всегда применяется нормальный водородный электрод. За условную величину, характеризующую потенциал рассматриваемого электрода, принимают э. д. с. гальванического элемента, составленного из этого электрода и нормального водородного электрода. Эту величину называют электродным потенциалом данного электрода (мы будем обозначать ее буквой Е, как э.д.с. цепи).
До недавнего времени в работах разных авторов использовались две противоположные системы знаков электродного потенциала. Теперь же в Международном союзе по чистой и прикладной химии (ЮПАК) достигнуто соглашение о рекомендации единой системы знаков. Принято электродному потенциалу присваивать знак, одинаковый со знаком заряда этого электрода по отношению к нормальному водородному электроду.
Таким образом, электродным потенциалом данного электрода называется величина, равная его потенциалу по отношению к нормальному водородному электроду. (Электродный потенциал данного электрода включает в себя разности потенциалов, отвечающие этому электроду в нормальному водородному электроду, а также соответствующий контактный потенциал).
Покажем, как определить зависимость величины электродного потенциала Е от концентрации ионов в растворе, на примере цинкового электрода в растворе, в котором активность ионов цинка равна a+. К ним применимы соотношения, выведенные для ЭДС обратимых цепей.
При записи цепей, служащих для определения электродного потенциала, принято водородный электрод указывать слева. Соответствующая химическая реакция записывается при этом в форме, отвечающей условию, что положительные ионы проходят через цепь в направлении слева направо, а отрицательные — справа налево. При положительном электродном потенциале указанная реакция обладает отрицательным G. Если же электродный потенциал в данных условиях отрицателен, то реакция может протекать самопроизвольно только в обратном направлении. Для определения электродного потенциала цинка при активности ионов его в растворе, равной a+, может служить гальваническая цепь, состоящая из двух полуэлементов — нормального водородного электрода и определяемого цинкового электрода. Такая цепь записывается в следующей форме:
Pt, Н2 | H+ Zn2+ Zn
aH+ = 1 aZn 2+ = a+
Реакция, которая протекает при работе гальванического элемента, отвечает уравнению:
Zn2+ + Н2 = Zn + 2Н+ (а)
а электродные процессы — на цинковом электроде Zn2+ + 2е- = Zn
и на водородном электроде H2=2H++2e- .
Электродный потенциал цинкового электрода численно равен ЭДС такого гальванического элемента. Знак электродного потенциала в общем случае зависит от соотношения концентраций (точнее — активностей) ионов в растворе. Электродный потенциал положителен, если эти концентрации таковы, что реакция в данных условиях может самопроизвольно протекать в прямом направлении (G<0). В противоположном случае — электродный потенциал отрицателен. Реакция (а) отвечает последнему случаю. В пределах концентраций, доступных в обычных условиях, она может протекать самопроизвольно только в обратном направлении. В соответствии с этим электродный потенциал цинка в обычных условиях отрицателен. Пользуясь уравнением
 (
(
 ,
когда все а
(активности)
равны
и равны 1; q,
r,
b,
d – стехиометрические коэффициенты
веществ Q,
R,
B,
D)
для выражения э.д. с. и учитывая, что
активности металлического цинка aZn,
газообразного водорода при р = 1бар
,
когда все а
(активности)
равны
и равны 1; q,
r,
b,
d – стехиометрические коэффициенты
веществ Q,
R,
B,
D)
для выражения э.д. с. и учитывая, что
активности металлического цинка aZn,
газообразного водорода при р = 1бар
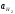 и
ионов водорода в нормальном водородном
электроде аH+
равны единице (aZn
=
и
ионов водорода в нормальном водородном
электроде аH+
равны единице (aZn
= = аH+
= 1), запишем уравнение, выражающее
зависимость электродного потенциала
цинкового электрода от активности ионов
цинка в растворе:
= аH+
= 1), запишем уравнение, выражающее
зависимость электродного потенциала
цинкового электрода от активности ионов
цинка в растворе:
 (3)
(3)
где
Е° — электродный потенциал цинка при
активности ионов его в растворе
 =
1, называемый нормальным (или стандартным)
потенциалом цинка и являющийся характерной
константой этого металла при данной
температуре.
=
1, называемый нормальным (или стандартным)
потенциалом цинка и являющийся характерной
константой этого металла при данной
температуре.
Уравнения вида (3) применимы и к другим металлам. Они выражают зависимость электродного потенциала Е данного электрода от активности соответствующих катионов в растворе, если под Е° подразумевать нормальный потенциал этого электрода.
Нормальным (стандартным) потенциалом данного электрода называется электродный потенциал его, когда активность ионов, которыми определяется электродный процесс, равна единице.
Для достаточно разбавленных растворов активность в уравнении (3) можно заменить концентрацией. В таком виде это уравнение часто называют уравнением Нернста или уравнением Нернста — Тюрина.