
IV. Процессы этерификации, гидролиза, гидратации, дегидратации
4.1. Процессы этерификации, гидролиза, гидратации, дегидратации
Процесс этерификации можно осуществлять в нескольких последовательно подключенных аппаратах с использованием общего обратного холодильника, из которого оборотный спирт стекает в первый аппарат каскада. Реакционную смесь можно вводить в зону реакции через обратный холодильник, в котором она подогревается за счет тепла конденсации паров.
В процессе этерификации через паровое пространство аппарата противотоком к реакционной смеси пропускают азот, который предотвращает попадание паров с более высокой концентрацией летучих из предыдущих секций в последующие и понижает парциальное давление паровой фазы над жидкостью, облегчая отгонку летучих. Использование мешалки с перфорированными, лопастями приводит к разбрызгиванию реакционной массы в паровом пространстве и также способствует интенсификации отгонки реакционной воды.
Учитывая, что отрицательное влияние воды особенно заметно при глубоких степенях превращения, для ряда процессов может оказаться целесообразным постепенное углубление вакуума вдоль аппарата. С этой целью, например, фирма «Фарбверке Хехст AG» (ФРГ) предлагает разделить секции глухими перегородками с переливными шиберными устройствами, расположенными ниже уровня жидкости. Переток жидкости из секции в секцию осуществляется за счет разности давлений, а расход регулируется автоматически шиберами, связанными с датчиками уровня, которые установлены в каждой секции.
Для интенсификации процесса предлагается использовать «две последовательно расположенные колпачковые. тарельчатые колонны с числом тарелок в каждой более пяти. Отношение высоты колпачка к диаметру рекомендуется выбирать равным 3:1, число отверстий в боковой стенке колпачка — не менее четырех, диаметр отверстий — 2—4 мм. Отверстия располагаются на высоте 5—20 мм от основания колпачка. В первой колонне получают продукт с кислотным числом 5—10 мг КОН/г, во второй — не более 0,5 мг KOH/г. Процесс проводят под давлением и при температуре выше 200 °С. Тепло отходящих паров воды и спирта используется для подогрева и испарения свежей порции спирта, подаваемого на вторую ступень. Технически это возможно, так как давление в реакторе первой ступени выше, чем в реакторе второй ступени.
Процессы гидролиза, гидратации, этерификации и амидирования имеют очень важное значение в промышленности основного органического и нефтехимического синтеза. Гидролизом жиров, целлюлозы и углеводов давно получают мыло, глицерин, этиловый спирт и другие продукты. В области органического синтеза эти процессы используются для производства низкомолекулярных спиртов, фенолов, простых эфиров, а-оксидов, ненасыщенных соединений, карбоновых кислот и их производных (сложных эфиров, ангидридов, нитрилов, амидов) и других соединений. Очень часто рассматриваемые реакции являются промежуточным этапом в многостадийных синтезах других продуктов целевого назначения.
Очень важное значение в промышленности основного органического и нефтехимического синтеза имеет такой процесс, как гидролиз. Применяя его в отношении жиров, целлюлозы и углеводов давно получают мыло, глицерин, этиловый спирт и другие ценные продукты. В области органического синтеза рассматриваемые операции используются главным образом для производства спиртов С2-С5, фенолов, простых эфиров, окисей, многих ненасыщенных соединений, карбоновых кислот и их производных (сложных эфиров, ангидридов, нитрилов, амидов), а также ацетальдегида и других соединений. Перечисленные вещества имеют очень важное применение в качестве промежуточных продуктов органического синтеза, мономеров и фенолов, эфиров акриловой и метакриловой кислот, меламинов, хлоролефинов, акрилонитрилов, пластификаторов и смазочных материалов. Также используют для растворителей (спирты, простые и сложные эфиры, хлоролефины), пестицидов, поверхностно-активных веществ и т.д.
Очень часто рассматриваемые реакции являются промежуточным этапом в многостадийных синтезах других продуктов целевого назначения. Кроме того, процесс гидролиза имеет очень важное значение. Это связано с тем, что они являются промежуточными стадиями при синтезе многих других веществ. Производство перечисленных выше продуктов имеет большие масштабы как у нас в стране, так и зарубежом.
Данным синтезом называют процессы замещения или двойного обмена, протекающие под действием воды или щелочей. Их можно классифицировать на реакции, идущие с расщеплением связей С-С1, С-О, C-N и др. При этом для хлорпроизводных кроме собственно процесса с замещением хлора может происходить щелочное дегидрохлорирование с образованием ненасыщенных соединений или окисей. Гидролиз по С-0 связи наиболее характерен для сложных эфиров, но в органическом синтезе более важна обратная ему реакция этерификации. К ней способны многие неорганические кислоты, а также их производные. Некоторые реакции гидратации равновесны; обратный процесс отщепления воды называют дегидратацией, которая может быть не только внутри-, но и межмолекулярной. Выделение воды происходит при многих органических процессах (этерификации, нитрования и др.). Поэтому данный термин применяют лишь к тем видам синтезирования, которые не имеют других, более определяющих систем классификации. Таким образом, видно, что близость с другими процесса гидролиза, объясняется наличием обратимых превращений и генетических связей.
Вода (или водяной пар в парофазных реакциях) в отсутствие катализаторов является очень слабым агентом, причем многие из рассмотренных выше реакций с ней вообще не идут или протекают настолько медленно, что становятся непригодными для практических целей. Это обусловлено тем, что данная жидкость представляет собой слабое основание и нуклеофильный реагент. Замена ее более активным гидроксильным ионом ведет к значительному ускорению процесса, который становится необратимым. Щелочной гидролиз особенно эффективен в случае хлорпроизводных; он применяется также при процессе производных карбоновых кислот (нитрилов, амидов, сложных эфиров).
Однако для ряда рассматриваемых реакции (гидратации ненасыщенных соединений, синтеза простых и сложных эфиров, всех процессов дегидратации и др.) щелочи неприменимы. В качестве щелочных агентов в промышленности применяют водные или водноспиртовые растворы NaOH, вещества более дешевой гидроокиси кальция, соды или других щелочных солей. Они оказывают более медленное и мягкое гидролизующее действие, которое может иногда отличаться от действия сильных щелочей. Для гидролиза органических соединений, а также для реакций гидратации, дегидратации и этерификации типично каталитическое влияние кислот.
Процессы гидролиза, гидратации, дегидратации, этерификации и амидирования имеют очень важное значение в промышленности основного органического и нефтехимического синтеза. Гидролизом жиров, целлюлозы и углеводов давно получют мыло, глицерин, этанол и другие ценные продукты. В области органического синтеза рассматриваемые процессы используют главным образом для производства спиртов С2- С5, фенолов, простых эфиров, -оксидов, многих ненасыщенных соединений, карбоновых кислот и их производных (сложных эфиров, ангидридов, нитрилов, амидов) и других соединений.
Перечисленные вещества имеют очень важное применение в качестве промежуточных продуктов органического синтеза (спирты, кислоты и их производные, альдегиды, -оксиды), мономеров и исходных веществ для синтеза полимерных материалов (фенол, эфиры акриловой и метакриловой кислот, меламин. хлоролефины), пластификаторов и смазочных материалов (сложные эфиры), растворителей (спирты, простые и сложные эфиры, хлоролефины), пестицидов (эфиры карбаминовой и тиокарбаминовой кислот). Очень часто рассматриваемые реакции являются промежуточным этапом в многостадийных синтезах других продуктов целевого назначения.
Производство перечисленных веществ имеет большие масштабы. Так, в США синтезируют по 500 тыс. т этанола и изопропанола. 900 тыс. т пропиленоксида, 200 тыс. т эпихлоргидрина, свыше 4 млн. т сложных эфиров, около 300 тыс. т изоцианатов.В этом и других случаях дегидратация с образованием ненасыщенных веществ чаще всего является одной из стадий в производстве многих мономеров. Так, в одном из новых процессов производят стирол дегидратацией метилфенилкарбинола. Известный метод синтеза изопрена из изобутена и формальдегида также связан с заключительной дегидратацией диола и ненасыщенного спирта.Другой вариант получения для ненасыщенных соединений, состоящий во введении винильной группы путем реакций типа альдольной конденсации с последующей дегидратацией, можно привести примеры синтеза нитроэтилена, винилметилкетона и 2-винилпиридина.
Путем побочного образования простых эфиров при гидролизе хлорпроизводных и гидратации олефинов получают все необходимое количество таких эфиров, как диизопропиловый. Но диэтиловый эфир имеет довольно широкое применение, и его специально производят межмолекулярной дегидратацией этанола при 2500С на гетерогенном катализатоое Аl2О3.
4.2. Лабораторная работа №3
Этерификации н-бутилового спирта уксусной кислотой
Цель работы:
1. Ознакомить студентов со способом проведения реакции этерификации.
2. Научить выделять полученный продукт из реакционной массы.
3. Закрепить знания по способам получения и химическим свойствам карбоновых кислот и их производных.
4. Выработать навыки обращения с химической посудой, реактивами.
5. Ознакомить с побочными процессами, проходящими при про ведении синтеза, со способами утилизации отработанных реактивов.
6. Привить навыки работы со справочной литературой и оформления отчета по лабораторной работе.
Реактивы: спирт этиловый, спиртовой раствор хлоргидрата гидроксиламина (0,5 н), кислота уксусная ледяная, кислота серная (конц.), раствор соляной кислоты (1 н), натрия карбонат (конц. раствор), кальция хлорид (насыщ. ратвор), раствор гидроксида натрия (конц.), раствор хлорида железа (III).
Посуда и приборы: установка для синтеза этилацетата, установка для перегонки этилацетата, делительная воронка, мерный цилиндр (25 смЗ), кипятильные камешки, капельная воронка, спиртовка, штатив с пробирками, лакмусовая бумага, коническая колба.
Общие положения
В органическом синтезе на основе карбоновых кислот получают амиды, нитрилы, ангидриды, галогенангидриды, сложные эфиры и другие производные. Эти реакции протекают по механизму нуклеофильного замещения гидроксила в карбоксильной группе с переходом углерода из sр2-состояния в sp3 и вновь в 8р2-гибридное состояние. Величина положительного заряда на углеродном атоме карбонильной группы в производных карбоновых кислот уменьшается в ряду: галогенангидрид - ангидрид - карбоновая кислота - сложный эфир. Это определяет не только активность атома водорода в а-положении, но и способность группы к нуклеофильному замещению. На реакции оказывают влияние нуклеофильность замещающей группы и пространственные факторы, например, в реакциях переэтерификации.
Важнейшим методом получения сложных эфиров является реакция этерификации - взаимодействие карбоновых кислот со спиртами. Реакция протекает при каталитическом воздействии серной кислоты. Наиболее легко вступают в реакцию первичные спирты и более сильные карбоновые кислоты. Реакция этерификации обратима, поэтому для увеличения выхода продукта необходимо постоянно удалять из реакционной колбы продукты реакции - сложный эфир и воду.
Лабораторная работа №4
Гидратация ацетилена
Цель работы:
1. Получить альдегиды окислительными реакциями.
2. Ознакомиться с качественными реакциями на альдегиды и кетоны.
3. Закрепить знания по способам получения и химическим свойствам кетонов.
4. Выработать навыки обращения с химической посудой, реактивами и приборами.
Реактивы: этиловый спирт, дихромат калия (кристаллический), серная кислота (разб. и конц.), карбид кальция, окись ртути (II) желтая, формальдегид, ацетальдегид, раствор щелочи (разб.), раствор сульфата меди, раствор нитрата серебра, рас- твор аммиака (разб.), раствор фуксинсернистой кислоты, ацетон, гидроксиламин гидрохлорид, карбонат натрия (безводный кристаллический), бисульфит натрия (насыщенный водный раствор), соляная кислота (разб.), фенолфталеин, раствор йода (10 \%).
Посуда и приборы: пробирка с отводной трубкой, штатив, пробирки, стаканы, спиртовка, медная проволочная сетка, пробирка с корковой пробкой, тигельные щипцы, колбочка с отводной трубкой, пробка с капельной воронкой, прибор для гидратации ацетилена, водяная баня, широкая пробирка, ледяная баня, колба Бунзена, воронка Бюхнера, водоструйный фильтровальная бумага, стеклянная палочка.
Общие положения
Альдегидами и кетонами называют производные углеводородов, содержащие карбонильную группу СО.
В молекуле альдегидов она затрачивает одну валентность на соединение с водородом, а вторую - на соединение с радикалом, который может быть предельного и непредельного характера.
Номенклатура карбонильных соединений весьма многообразна. Используют как исторические названия, так и систем. Альдегидную группу по номенклатуре ИЮПАК обозначают суффиксами -аль, -карбальдегид или префиксами оксиформил. Если альдегидная группа является старшей, ее обозначают суффиксом. Если углеродный атом альдегидной группы входит в родоначальную структуру, применяется суффикс -аль, в других случаях -карбальдегид. Префиксы оксо- или формил- применяются, если в молекуле имеются более старшие группы, например -S03H, -COOH. Кетонную группу по системе ИЮПАК обозначают суффиксом -он или префиксом оксо- (кето-). Префикс применяется, если в молекуле имеются более старшие группы. По рациональной номенклатуре названия кетонов состоят из названий углеводородных остатков в порядке старшинства и суффикса -кетон. Многие альдегиды и кетоны сохранили тривиальные названия: формальдегид, ацетальдегид, ацетон.
Методика выполнения работы
Образование ацетальдегида при окислении спирта. В пробирку с отводной трубкой всыпьте 0,5 г дихромата калия, а затем прилейте 2 смЗ разбавленной серной кислоты и 2смЗ спирта и смесь встряхните. Наблюдается разогревание и изменение окраски смеси. Закрепите пробирку наклонно в лапке штатива и присоедините отводную трубку, конец которой погружен почти до дна другой пробирки-приемника, содержащей 2 смЗ холодной воды. Приемник поместите в стаканчик с холодной водой. Осторожно нагрейте реакционную смесь, пламенем горелки, регулируя равномерное кипение смеси, избегая переброса. В течение 2-3 мин объем жидкости в приемнике увеличивается почти вдвое, после чего прекратите нагревание и разберите прибор. Отгон в приемнике имеет резкий запах ацетальдегида. Раствор используйте для последующих опытов. В полученном отгонкой водном растворе кроме главного продукта реакции - ацетальдегида содержатся также спирт, уксусная кислота и ацеталь; последний образуется в результате взаимодействия ацетальдегида с еще неокисленным спиртом.
При окислении спирта образуются небольшие количества и других побочных продуктов - этилсерная кислота, уксусноэтиловый эфир, паральдегид, двуокись углерода, сернистый ангидрид.
Образование альдегидов из спиртов при отщеплении водорода (дегидрировании). К обычной пробирке подберите корковую пробку. Затем полоску тонкой медной сетки сверните в плотный цилиндр длиной 4-5 см, свободно входящий в ту же пробирку, но заполняющий почти весь ее просвет. Поместите в сухую пробирку 3 смЗ исследуемого спирта и 2 смЗ воды. Затем сильно накалите свернутую сетку, держа ее тигельными щипцами в пламени горелки, при этом медь чернеет. Быстро вложите горячую сетку в пробирку со спиртом и тотчас же неплотно закройте пробирку пробкой. Спирт бурно вскипает, появляется характерный запах альдегида, а медная сетка становится ярко- красной. Когда бурное кипение спирта прекратится, вставьте пробку плотнее и охладите пробирку в стакане с холодной водой. Затем выньте пробку, перелейте жидкость в другую пробирку и добавьте к ней примерно равный объем воды, которой предварительно ополаскивают свернутую сетку в первой пробирке. Получают водно-спиртовой раствор формальдегида (из метилового спирта) или ацетальдегида (из этилового спирта), который дает все характерные для альдегидов реакции. Применяя такой раствор для последующих опытов, полезно в параллельных пробах убедиться, что исходный спирт не дает этих реакций. Реакция восстановления карбонильной группы альдегидов и кетонов водородом (с образованием соответствующих спиртов).
V. Процессы присоединения и конденсации по карбонильной группе
Реакция Канниццаро
В 1953 г. Канниццаро установил, что ароматические альдегиды под действием концентрированного раствора щелочи претерпевают окислительно-восстановительное превращение (диспропорционирование). Примером этой реакции может служить превращение бензальдегида в бензиловый спирт и бензойную кислоту:

В реакцию Канниццаро вступают не только муравьиный альдегид и те альдегиды, у которых третичным атомом углерода, например: ароматические альдегиды, но карбонильная группа связана с третичным атомом углерода, например:
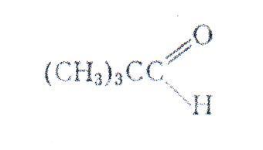
Большинство альдегидов жирного ряда не вступает в эту реакцию, так как в слабощелочной среде они конденсируются по типу альдольного уплотнения.
Широкое применение находит так называемая «перекрестная» реакция Канниццаро, в которой ароматический и гетероциклический альдегиды восстанавливаются до соответствующего спирта под действием формальдегида, окисляющегося при этом в муравьиную кислоту:
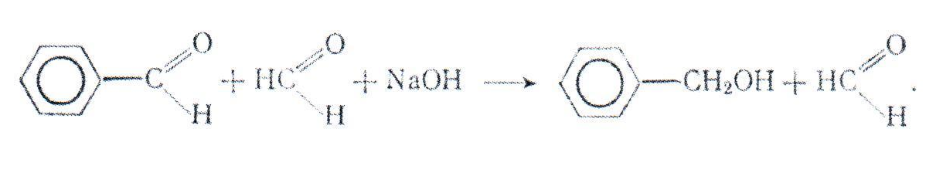
Эта «перекрестная» реакция Канниццаро используется для восстановления большого числа различных альдегидов. Так, например, этой реакцией можно получить фурфуриловый спирт из фурфулола.
Реакция Клайзена
Реакция Клайзена относится к типу альдольных реакций и заключается в конденсации сложных эфиров с соединениями, содержащими активную метиленовую группу (сложные эфиры, кетоны, нитрилы), в присутствии основных катализаторов (металлический натрий, амид натрия и некоторые магнийорганические соединения). Так, например, при конденсации сложных эфиров образуются Р-кетоэфиры:
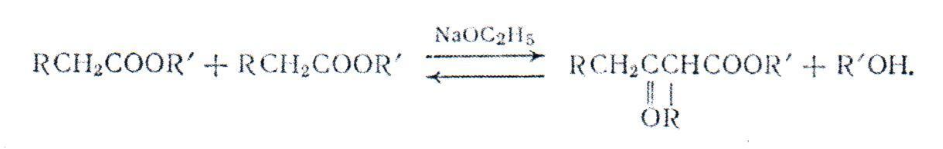
При конденсации сложных эфиров с кетонами образуются Р-дикетоны:
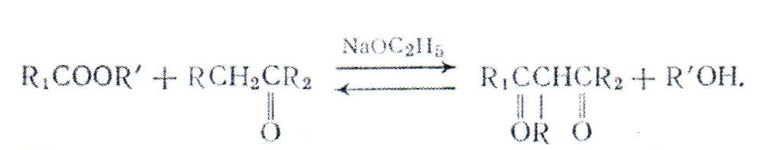
Во всех случаях получения (3-кетоэфиров и Р-дикетонов необходимо применять чистые безводные исходные вещества и тщательно высушенную аппаратуру, защищенную от доступа влаги.
Классическим примером сложноэфирной конденсации является синтез ацетоуксусного эфира из этилацетата в присутствии металлического натрия или этилата натрия.
В настоящее время установлено, что конденсирующим средством является не металлический натрий, а алкоголят натрия (для получения ацетоуксусного эфира - этилат натрия). Металлический натрий, вводимый в реакцию, взаимодействует с этанолом, следы которого всегда имеются в этилацетате. Выделяющийся во время реакции этанол постепенно растворяет натрий и, таким образом, этилат натрия все время образуется по мере течения реакции:

Однако наличие больших количеств этанола в этилацетате вредно, так как сложноэфирная конденсация обратима: ацетоуксусный эфир под действием этанола и этилата натрия распадается на две молекулы исходного сложного эфира. Под влиянием этилата натрия образуется натрийзамещенный этилацетат:
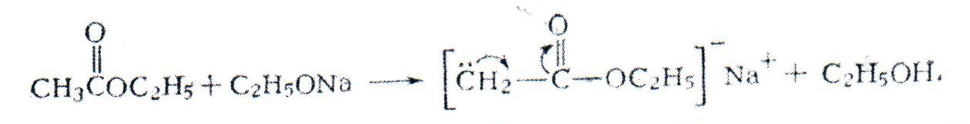
Полученное соединение реагирует с другой молекулой этилацетата, образуя комплекс I:
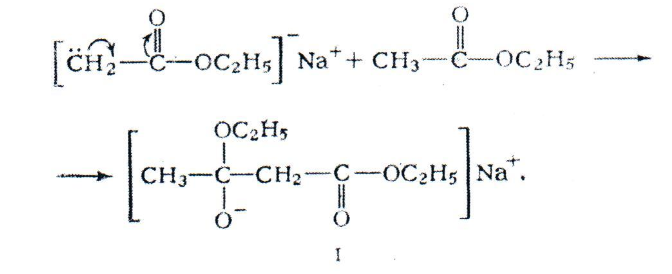
Комплекс I отщепляет молекулу С2Н50Н образуя натрий замещенный эфир [СН3СОСНСООС2Н5] NA . При действии на него уксусной кислоты образуется свободная фенольная форма ацетоуксусного эфира, переходящая в кетонную до положения равновесия:
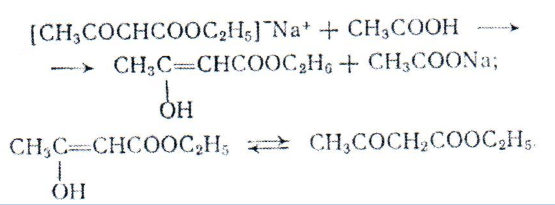
Аналогичным образом при конденсации сложных эфиров с кетонами получаются (З-дикетоны.
Примером этого типа конденсации является синтез бензоилацетона из ацетофенона при действии металлического натрия.
Растворителем при сложноэфирной конденсации обычно служит избыток сложного эфира, однако в некоторых случаях применяют диэтиловый эфир или толуол.
При синтезе ацетоуксусного эфира избыток этил ацетата не только служит растворителем, но и препятствует образованию побочных продуктов а-дикетона и ацилоина, которые могут получаться в присутствии больших количеств натрия.
Сложноэфирная конденсация — частный случай реакции конденсации, которая очень распространена и разнообразна. Целый ряд органических соединений, как в синтетической химии, так и в природе, является результатом конденсации.
5.1. Лабораторная работа №5
Получение бензойной кислоты
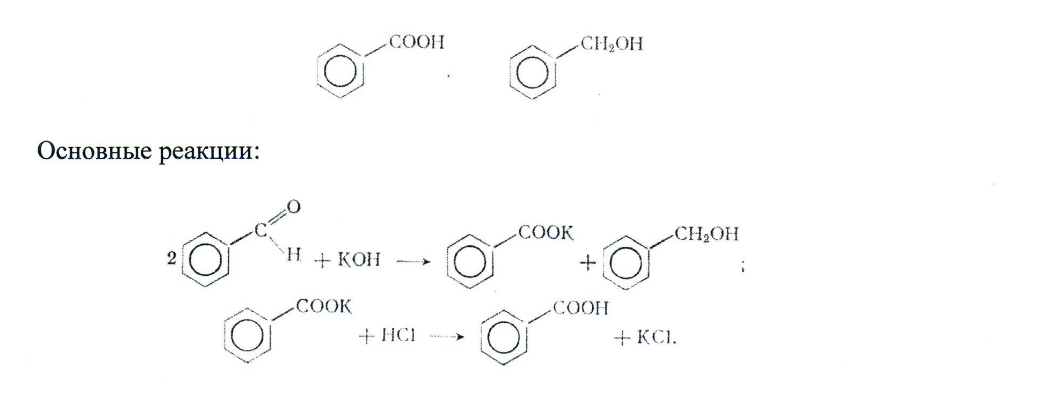
Реактивы:
Бензальдегид 20 г (-0,2 моль), гидрооксид 18 г, диэтиловый эфир 45 мл, гидросульфат натрия, 10 мл 40 %-й раствор, карбонат натрия, сульфит натрия безводный, хлороводородная кислота (1:1)
Посуды и приборы:
Плоскодонная колба (250 мл), холодильник воздушный, воронка делительная, колбы Вюрца (100 мл), холодильник Либиха, термометр, аллонж изогнутый, колбы конические плоскодонные (100 мл), колба Бунзена, воронка Бюхнера, предохранительная склянка, стакан химический (100 мл).
Сборка приборов
1. Колбу Вюрца вместимостью 100 мл, помещенную на водяную баню, соединяют с термометром и нисходящим водяным холодильником с алонжем, который опускают в приемник.
2. Колбу Вюрца вместимостью 100 мл, снабжают термометром и нисходящим воздушным холодильником, который опускают в приемник.
3. Прибор для отсасывания
Выполнение синтеза
В плоскодонную колбу вместимостью 250 мл помещают 20 г свежеперегнанного бензальдегида и при охлаждении вносят холодный раствор 18 г гидроксида калия в 12 мл воды. Закрывают колбу пробкой с боковой прорезью и содержимое колбы энергично встряхивают до тех пор, пока не образуется стойкая эмульсия. После этого смесь оставляют на 10-12 ч. Затем к образовавшейся смеси бензилового спирта и кристаллической массы бензоата калия прибавляют небольшое количество воды, необходимое для растворения выделявшихся кристаллов, и переливают раствор в делительную воронку. Следует избегать большое количество воды, так как бензиловый спирт частично растворяется в воде (в 100 мл воды растворяется 4 г при 17 °С). Из этого раствора извлекают бензиловый спирт диэтиловым эфиром, делая 2-3 эфирные вытяжки, по 15 мл каждая. Эфирные вытяжки соединяют и встряхивают, добавляя дважды по 5 мл 40%- го раствора гидросульфита натрия.
Эфирные вытяжки обрабатывают концентрированным раствором гидросульфита натрия для удаления непрореагировашего бензойного альдегида, который образует бисульфитное производное, не растворяющееся в эфире.
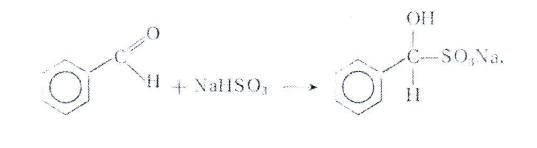
Затем промывают эфирный слой раствором карбоната натрия для освобождения от сернистой кислоты, которая может быть в растворе гидросульфита натрия. Перелив органический слой из делительной воронки в колбу, сушат его безводным сульфатом натрия или безводным карбонатом калия. Высушенный эфирный раствор переливают в колбу Вюрца на 100 мл, тщательно отгоняют эфир на водяной бане (прибор 2), собирая фракцию, кипящую в пределах 204—206°С.
Выход бензинового спирта
Бензиновый спирт (фенил карбинол) — бесцветная жидкость со слабым приятным запахом; плохо растворим в воде, хорошо растворяется в этаноле, хлороформе, диэтиловом эфире. М=108,13; /кип = 205,8°С или 93°С при 1,3-КГЗ МПа; Шл=—15,3°С; р=1045,5 кг/м3; п
Применяется как растворитель лаков, а также в парфюмерной промышленности.
Воднощелочной раствор, слитый из делительной воронки после экстрагирования диэтиловым эфиром, подкисляют хлороводородной кислотой (1:1) (по Конго красному). Выпавшую бензойную кислоту отсасывают на воронке Бюхнера и сушат. Для получения более чистой бензойной кислоты следует перекристаллизовать ее из кипящей воды.
Выход бензойной кислоты =9г.
Бензойная кислота - бесцветные блестящие листочки, плохо растворяется в холодной воде, лучше- в горячей (в 100 мл воды растворяется 0,2 г при 17°С и 2,2 г при 75°С), хорошо растворяется в хлороформе, ацетоне, тетрахлорметане, бензоле, метаноле. М= 122,05; tiam= 250°С; глл=122,3°С; р=1265,9 кг/м3.
Отличительные реакции бензинового спирта
1. При окислении бензинового спирта хромовой смесью или перманганатом калия образуется бензойная кислота.
2. К 2 мл разбавленной азотной кислоты прибавляют 1 каплю бензинового спирта и погружают пробирку в кипящую воду—образуется желтоватая эмульсия и появляется силный запах бензальдегида.
Отличительная реакция бензойной кислоты
К 1 мл раствора бензойной кислоты прибавляют по 1 капле 0,3%- го раствора пероксида водорода и раствора хлорида железа (III). Пробирку с этой смесью погружают в кипящую воду. Вследствие образования салициловой кислоты появляется красно- фиолетовая окраска.
5.2.Лабораторная работа № 6
Получение бензинового спирта
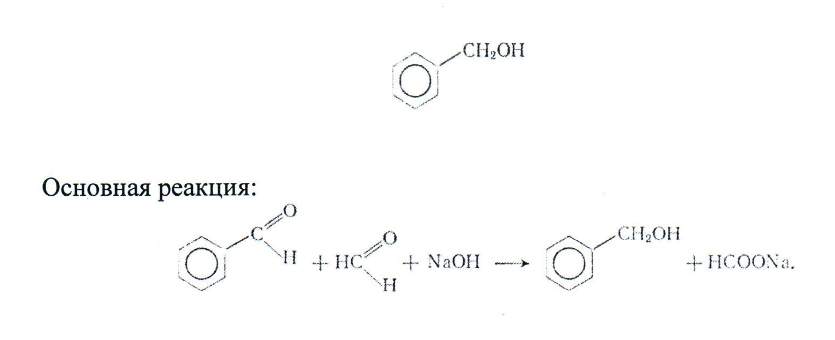
Реактивы:
Бензальдегид 25 г (23,8 мл), формалин 50 мл, гидроксид натрия 50 мл, 40%-й раствор, гидросульфит натрия
Посуды и приборы:
Круглодонная двугорлая колба (500 мл), делительная воронка, холодильник шариковый , мешалка, колба Вюрца (250 мл), воздушный холодильник, колбы конически плоскодонные (100 мл)
Сборка приборов
1. Двуголую колбу снабжают мешалкой и обратным холодильником.
2. В колбу Вюрца вставляют термометр и подсоединяют воздушный холодильник с аллонжем и приемником.
Выполнение синтеза
В двугорлую колбу вливают 25г бензальдегида, 60 мл воды и 50мл формалина. При постоянном перемешивании добавляют раствор гидрооксида натрия. Температура реакционной массы повышается до 70°С. Затем реакционную массу оставляют стоять в течение 10 ч. Жидкость разделяют на два слоя. Верхний слой — бензиновый спирт — отделяют, промывают раствором гидросульфита натрия и водой, высушивают безводным сульфатом натрия и перегоняют, собирая фракцию, кипящую в пределах 204-206°С.
