
- •Введение
- •Модуль 2 Дисперсные системы содержание
- •Модуль 2 Дисперсные системы
- •2.1 Способы выражения концентрации раствора
- •2.2 Коллигативные свойства растворов
- •2.3 Теория электролитической диссоциации
- •2.3.1 Ионные уравнения реакций
- •2.3.2 Ионное произведение воды. Водородный показатель. Гидроксильный показатель.
- •2.3.3 Равновесия в растворах электролитов.
- •2.4 Коллоидные растворы
- •2.5 Контрольные задания
- •Приложение
- •Литература
2.3.3 Равновесия в растворах электролитов.
Гидролиз солей. Химическое обменное взаимодействие ионов растворенной соли с молекулами воды, приводящее к образованию слабодиссоциирующих продуктов (кислот, оснований, кислых анионов, основных катионов) и сопровождающееся изменением рН среды, называется гидролизом соли. Из определения следует, что гидролизу подвергаются не все соли: если взаимодействие между ионами соли и молекулами воды не происходит, то гидролиз отсутствует:
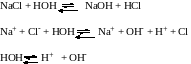
Практически идет обратная реакция - нейтрализация, с образованием слабого электролита Н2О.
В этом состоит сходство гидролиза с другими обменными реакциями электролитов - кислот, оснований, солей. Отличия реакций солей с водой от их реакций с кислотами и щелочами связаны с электролитическими особенностями воды. Как и кислоты, вода образует при диссоциации Н+ - ионы и как щелочи – ОН- - ионы. Но и те и другие присутствуют в чистой воде в очень небольшой концентрации (10-7 моль/л). Поэтому гидролиз ионов соли происходит, во-первых, обратимо, кроме отдельных случаев, во вторых, для многозарядных ионов - ступенчато. При составлении уравнений реакций гидролиза следует помнить, что во избежание распространенной ошибки нельзя использовать более одной молекулы воды на один ион соли:
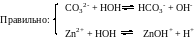

Известны три типичных случая:
1) Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону, который связывает ОН- - ионы воды; в растворе накапливаются ионы водорода Н+, и раствор приобретает кислую реакцию среды, рН<7.

Характер гидролиза: частичный, обратимый, ступенчатый.
2) Соли, образованные сильным основанием и слабой кислотой, гидролизуются по аниону, который связывает Н+-ионы воды; в растворе накапливаются ОН- ионы, создавая щелочную среду, рН>7.

Характер гидролиза: частичный, обратимый.
3) Соли, образованные слабым основанием и слабой кислотой, гидролизуются по катиону и по аниону
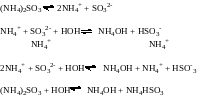
Кдисс. (HSO3-) = 6,3 10-8 Кдисс (NH4OH) = 1,8 10-5
Анион SO32- - гидролизуется сильнее, Н+ - ионов связывается больше, чем ОН- -ионов. Среда раствора слабощелочная.
Характер гидролиза: полный, обратимый, ступенчатый.
Количественно гидролиз характеризуют степенью гидролиза (h) и константой гидролиза (Кг). Степень гидролиза - это отношение концентрации соли, подвергшейся гидролизу (Сг) к общей концентрации соли в растворе (См)
 или
или
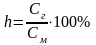
1) Для соли, гидролизующейся по аниону:
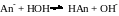
Константа равновесия, описывающая этот процесс, равна

где [HOH] CН2О = const, так как на гидролиз соли расходуется незначительное количество воды;
Если умножить левую и правую части уравнения на [H2O], то в левой части уравнения окажутся две постоянные К и [H2О]. Произведения двух постоянных называются константой гидролиза (Кг):

Если в уравнении (6) числитель и знаменатель дроби умножить на одну и ту же величину [H+], то в числителе можно выделить ионное произведение воды:
Кw = [OH-]∙[H+]
 ,
,
где
 .
.
Концентрация [OH-] = h Cм, где h – степень гидролиза, которая связана с константой гидролиза уравнением
 .
.
Так
как степень гидролиза очень мала, то
 .
.
[OH-]
= h
Cм
=

 )
)
2) Для соли, гидролизующейся по катиону:
Kt+ + HOH KtOH + H+
Константа равновесия равна

Константа гидролиза в этом случае равна
 ,
,
Где
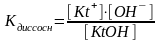
Концентрация H+ равна [H+] = h Cм
 ,
,
[H+]
= h
Cм
=

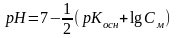
Числовые значения констант диссоциации кислых анионов и основных катионов значительно меньше констант диссоциации соответствующих кислот и оснований. Поэтому гидролиз идет преимущественно по I ступени:
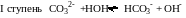



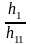 =
=
100
100
Гидролиз аниона СО32- по первой ступени превышает гидролиз по второй ступени примерно в 100 раз.
Растворимость. Произведение растворимости.
При растворении вещества может возникнуть равновесие, при котором скорость растворения фазы равна скорости ее образования:
растворение
Р астворяемое
вещество (фаза)
раствор
астворяемое
вещество (фаза)
раствор
образование фазы
При растворении изменение энергии Гиббса равно нулю (G = 0). Раствор, в котором устанавливается равновесие между растворением и образованием вещества (кристаллизация, осаждение), называется насыщенным, а концентрация раствора – растворимостью, Ср.
Большинство веществ обладает ограниченной растворимостью в воде и других растворителях. Поэтому на практике часто приходится встречаться с системами, в которых в состоянии равновесия находятся осадок и насыщенный раствор электролита

В
соответствии с законом действующих
масс, в состоянии равновесия скорость
прямой
 и обратной
и обратной
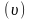 реакций, равны:
реакций, равны:
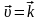
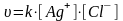
В состоянии равновесия:
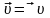


где К – константа равновесия.
В общем виде для равновесия AmBn m An+ + n Bm-
ПР = [An+]m [Bm-]n,
где m и n - число ионов, образующихся в результате диссоциации 1 моля электролитов, ПР – произведение растворимости электролитов.
При смешивании растворов электролитов осадок образуется только в том случае, если произведение концентраций ионов превысит величину ПР.
Равновесия с участием комплексных ионов будут рассмотрены далее в Модуле 3.Строение атома и химическая связь в соединениях.
