
- •Физическое материаловедение
- •3.1. Фазовые равновесия.
- •3.2. Правило фаз. Закон Гиббса.
- •Физическое материаловедение
- •3.3 Кристаллизация металлов и сплавов
- •3.3.1. Энергетические условия процесса кристаллизации
- •3.4. Механизм процесса кристаллизации
- •3.5. Методы построения дфр.
- •Экспериментальные методы, используемые для построения дфр.
- •3.6. Фазовые переходы.
- •1). Принцип непрерывности
- •2). Принцип соответствия
- •Все линии двойных диаграмм и поверхности тройных диаграмм ограничивают фазовые области, число фаз в которых различается между собой на единицу.
- •Для сплава любого состава пересечение его ординатой (у )линий (поверхностей) на диаграмме в процессе охлаждения или нагрева сопровождается изменением фазового состава.
- •3.8. Возможные фазовые переходы
3.4. Механизм процесса кристаллизации
Процесс кристаллизации состоит из двух элементарных процессов. Первый процесс заключается в зарождении мельчайших частиц кристаллов, которые называются зародышами или центрами кристаллизации. Второй процесс состоит в росте кристаллов из этих центров.
Модель кристаллизации металла в первые 7 секунд охлаждения представлена схемой процесса кристаллизации (рис.3.3) и кинетической кривой кристаллизации (рис.3.4).
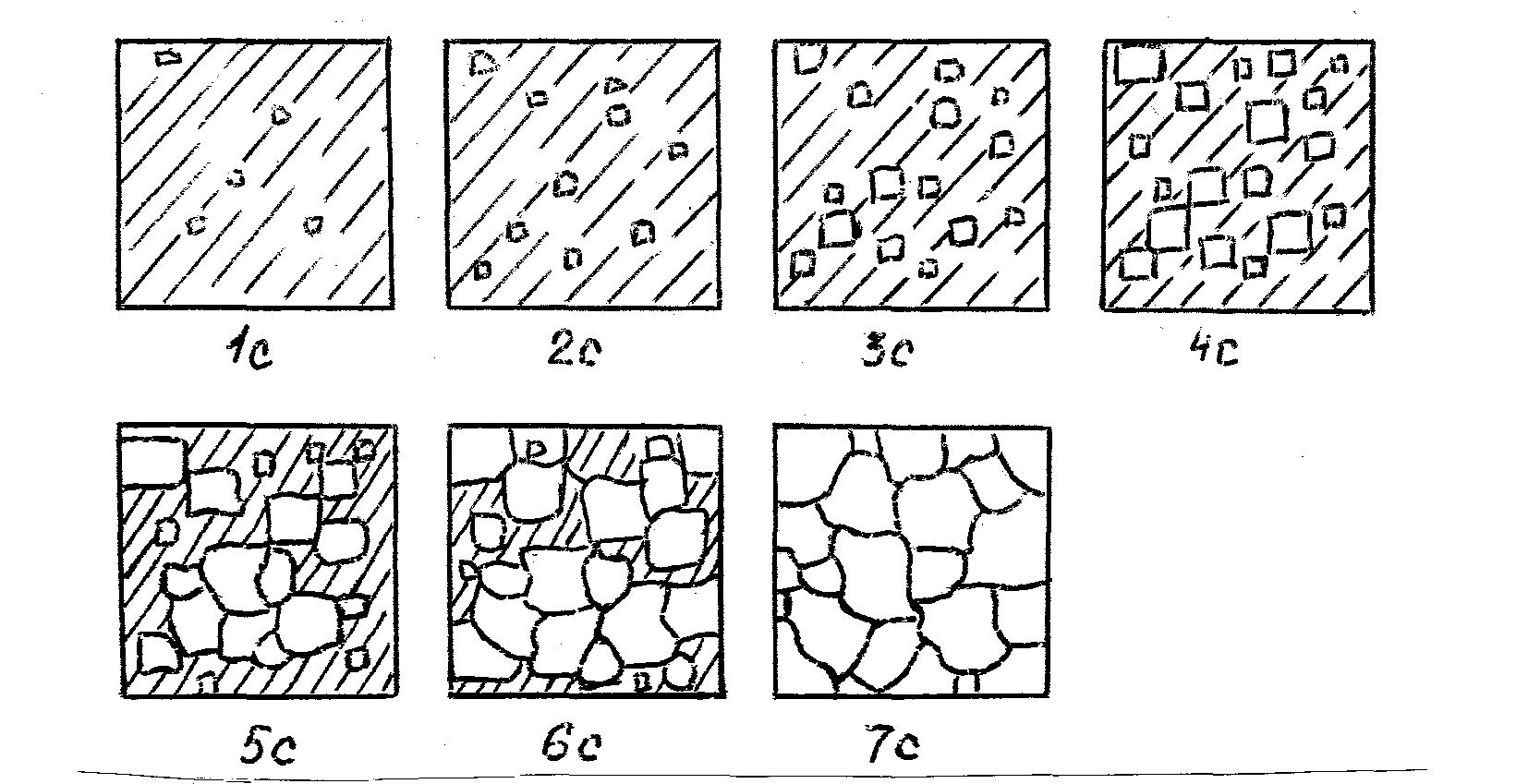
Рис. 3.3. Схема процесса кристаллизации
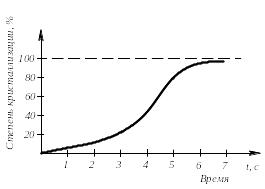
Рис. 3.4. Кинетическая кривая кристаллизации
По мере развития кристаллизации в нем участвуют все большее и большее число кристаллов. Поэтому процесс вначале ускоряется, пока в какой-то момент взаимное столкновение растущих кристаллов начинает заметно препятствовать их росту. Рост кристаллов замедляется еще и потому, что количество жидкости, в которой образуются новые кристаллы, становится все меньше. В процессе кристаллизации, пока кристалл окружен жидкостью, он часто имеет правильную форму, но при столкновении и срастании кристаллов их правильная форма нарушается. Внешняя форма кристалла оказывается зависимой от условий соприкосновения растущих кристаллов. Вот почему кристаллы металла - зерна (кристаллиты) не имеют правильной формы.
Скорость всего процесса кристаллизации количественно определяется двумя величинами: скоростью зарождения центров кристаллизации и скоростью роста кристаллов (рис.3.5).
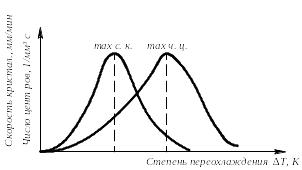
Рис. 3.5. Зависимость скорости кристаллизации (СК) и скорости зарождения центров кристаллизации (ЧЦ) от степени переохлаждения
Величины оптимального переохлаждения до достижения максимальной скорости кристаллизации (СК) и до образования максимального числа центров кристаллизации (ЧЦ) не совпадают.
Размер образовавшихся кристаллов зависит от соотношения СК и ЧЦ. При большом значении СК и малом значении ЧЦ образуется мало крупных кристаллов. При малых значениях СК и больших ЧЦ образуется большое число мелких кристаллов.
Размер зерна определяется по формуле
N = k СК / ЧЦ,
где N – размер зерна;
k - коэффициент пропорциональности;
СК – скорость кристаллизации;
ЧЦ – число центров кристаллизации
Минимальный размер способного к росту зародыша называется критическим размером зародыша.
Определив степень свободы для чистого металла и сплава в жидком состоянии и в момент кристаллизации, можно построить кривые нагрева в координатах температура – время (рис.3.6.1, 3.6.2).
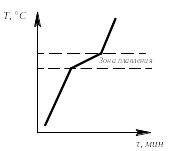
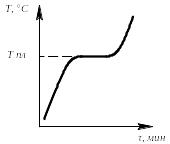 Рис.
3.6.1. Кривая нагрева Рис.
3.6.2. Кривая нагрева
Рис.
3.6.1. Кривая нагрева Рис.
3.6.2. Кривая нагрева
чистого металла сплава
Фазовые равновесия можно описать как аналитически, так и графически. Для графического описания используют диаграммы фазовых равновесий (ДФР) или фазовые диаграммы (ФД), которые иногда не точно называют диаграммами состояния системы.
ДФР однокомпонентной системы представляет собой геометрическое изображение фазовых состояний, которые реализуются в однокомпонентной системе при тех или иных внешних параметрах. ДФР однокомпонентной системы строят в координатах (Р – Т)
ДФР многокомпонентной системы (К>1) представляют собой геометрическое изображение фазовых состояний (равновесий и превращения фаз), которые реализуются при тех или иных параметрах в результате взаимодействия компонентов, входящих в систему. ДФР многокомпонентной системы строят в координатах Р – Т – Х, где Х – концентрация компонента.
Каждая точка ДФР характеризует параметры физико-химических систем, образующиеся в результате взаимодействия компонентов, слагающих ДФР.
(академик Курдюмов Н.С. – основатель физико-химического анализа).
ДФР могут быть 2-х мерными, 3-хмерными т.д.
Пример
С помощью ДФР для данных условий можно определить:
1) число фаз в системе;
2) относительное количество каждой из фаз;
3) состав каждой фазы и ее природу, (т.е. чистый компонент, раствор, соединение и т.д.)
4) характер фазовых превращений.
Следует иметь в виду, что ДФР без специальных пояснений не дает информацию об атомном строении фаз и их кристаллической решетке. ДФР может считаться полностью достоверной только после того, как с помощью рентгеноструктурного анализа (РСА) расшифровано атомное строение каждой из фаз данной системы.
