
- •Учебное пособие
- •Введение
- •1. Кристаллическое строение металло в
- •2. Кристаллизация металло в и строение металлическо - го слитка
- •3. Фазы в металлических сплавах
- •4. Диаграммы фазового равновесия двойных систем (диаграммы состояния)
- •5. Деформация и разрушение металло в
- •6. Механические свойства металлов
- •7. Влияние нагрева на структуру и свойства деформированного металла
- •8. Д иаграмма состояния железо-углерод (метастабильная д иаграмма)
- •9. Легирующие элементы в сплавах железо-углерод
- •10. Стабильная д иаграмма состояния железо-углерод (графит)
- •11. Чугуны
- •12. Фазовые превращения в сплавах железо-углерод (тео рия термическо й обработки)
- •2. Превращение пер еохл аж д енного ауст енит а
- •1 3. Превращение при непрерывном охлаждении
- •14. Техно ло г ия термическо й обработки металлов и сплавов
- •15. Список литера туры
4. Диаграммы фазового равновесия двойных систем (диаграммы состояния)
Диаграммы фазового равновесия (диаграммы состояния) - это графическое изображение фазового состава сплава в условиях равновесия в зависимости от температуры и химического состава сплава.
ФАЗОВОЕ РАВНОВЕСИЕ


Закономерности существования фаз в состоянии равновесия определяет правило фаз Гиббса С = К – Ф + 1 (Р = const). С – число степеней свободы (число внешних (Т0) и внутренних (состав) факторов, которые можно изменять, не меняя фазового равновесия); К – число компонентов; Ф – число фаз;
при К = 2, Ф = 3→С = 0 – нонва-риантное равновесие;
Ф = 2→С = 1
моновариантное
Ф = 1→С = 2
равновесие
Условие равновесия – минимум свободной энергии Гиббса

Сα, Сβ - составы равновесных фаз
Диаграммы состояния строят экспериментально по кривым охлаждения сплавов. На кривых охлаждения определяют критичес кие то ч к и – те м пе р а -туры перегиба или площадки на кривой, связанные с те пл о в ым эффектом фазового превращения. По ним определяют температуру превращения.

20
ТИПЫ ДИАГРАММ СОСТОЯНИЯ
К
 омпоненты
н еограни-ченно
растворяются как в жидком, так и в
твердом состоянии.
омпоненты
н еограни-ченно
растворяются как в жидком, так и в
твердом состоянии.

А11В1 ла
линия Т нача-крис тал лиз ации сплавов - ликвидус. А22В, - линия Ти конца кристаллизации сплавов - солидус. В структуре любого сплава этой системы - у твердый раствор компонентов А и В друг в друге.

Схема микроструктуры /твердого раствора
Компоненты ограниченно растворимы друг в друге в твердом состоянии и кристаллизуются с образованием эвтектики.

а - ограниченный твердый раствор В в А. Предельная растворимость изменяется по линии СF.
р - ограниченный твердый раствор А в В. Предельная растворимость изменяется по линии DG.
При температуре tе и концентрации е обра зуется эвтектика - смесь кристаллов двух фаз, одновременно кри сталлизующихся из жидкости по эвтек тической реакции.

Схема структуры эвтектического сплава
Ье-^ас+рД.
Компоненты
зуют друг


АmBn – устойчивое химическое соединение, образующееся при химическом составе сплава, который отвечает то ч к е
Д7.
а - ограниченный твердый раствор
В(А).
р - ограниченный твердый раствор
А(В).
у - ограниченный твердый раствор на базе решетки химического соединения АщВп.
21
ДИАГРАММЫ СОСТОЯНИЯ
В данной системе структура формируется
в результате перитектической
реакции
-выделившиеся
из жидкости кристаллы
а
раствора
взаимодействуют
с жидкой фазой, образуя новую |3
фазу.
данной системе структура формируется
в результате перитектической
реакции
-выделившиеся
из жидкости кристаллы
а
раствора
взаимодействуют
с жидкой фазой, образуя новую |3
фазу.

При температуре 11850С происходит перитектиче-ская реакция
11 85 С
Lc + аа > рь
а - твердый раствор на базе решетки Pt;
р - твердый раствор на базе решетки Ag.

Компоненты имеют полиморфное превращение – изменение типа кристаллической решетки при определенной температуре. Полиморфное превращение вызывает фазовые превращения в тв е р д о м состоянии.
М$ще&тр$ций 8, %
в)
а) полиморфное превращение
А* о А т ; Ва о Вр;
Т
А
б) эвтекоидное - распад Р тве рдого раствора
->ad + а е.
в) перитектоидное
Гр+Рс
т
>ак
22
J ДИАГРАММЫ
СОСТОЯНИЯ И СВОЙСТВА СПЛАВОВ
ДИАГРАММЫ
СОСТОЯНИЯ И СВОЙСТВА СПЛАВОВ


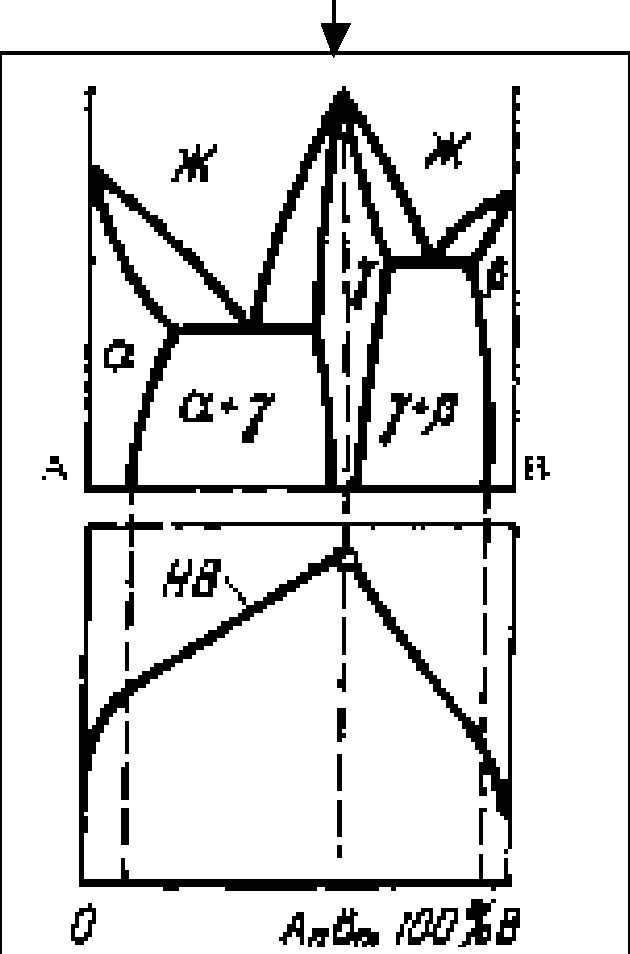
Свойства сплавов зависят от их состава с максимум или минимум при составе сплава 50 % А и 50 % В.

Свойства меняются в зависимости от состава по кривой линии в области тв е р д ых растворов и по линейному закону в двухфазной области.
Свойства сплавов характеризуются наличием максимума при составе сплава, образующего химическое с оединение.
Х имический
состав фаз любого сплава системы
можно определить с помощью
каноды, а их количество – по правилу
рычага.
имический
состав фаз любого сплава системы
можно определить с помощью
каноды, а их количество – по правилу
рычага.

b/ - состав жидкой фазы, L; a/ - состав тв е р д о й фазы, α; QL – ac/ad⋅100% - количество жидкости, %; Qα = cd/ab⋅100 % - количество α фазы, %.
23
ВОПРОСЫ И ЗАДАЧИ ПО ТЕМЕ
Что представляют из себя диаграммы состояния, почему их называют равновесными?
Что так о е компонент сплава?
Что та к о е кривая охлаждения; критичес кая то ч к а , что она показывает?
Что так о е эвтектика, при каких условиях она образуется?
Что та к о е перитектическое превращение?
Какие линии диаграммы носят название ликвидус и солидус, линии предельной растворимости?
Как повлияет на тв е р д о с ть сплава появление в его структуре химического соединения?
Что так о е эвтектоид, каковы условия его образования?
Что так о е полиморфное превращение, как оно представлено на диаграммах состояния?
10. Как зависит изменение свойств сплавов от типа диаграмм состояния?
ЗАДАЧИ
Задача № 1
На рис. 5 представлена диаграмма состояния двух компонентов, кристаллизующихся с образованием эвтектики. Расставить фазы и определить структуру сплавов при Т0ком. Зарисовать структуру сплавов при Т0ком. (сплавы 20 % В, 50 % В, 80 % В).

Рис.5 Задача № 2
Для сплава 1 (рис. 5) по дс читать количество фаз и структурных составляющих при температуре tе.
24
Задача № 3
Определите фазы в сплавах, строение которых показано на рис. 6.
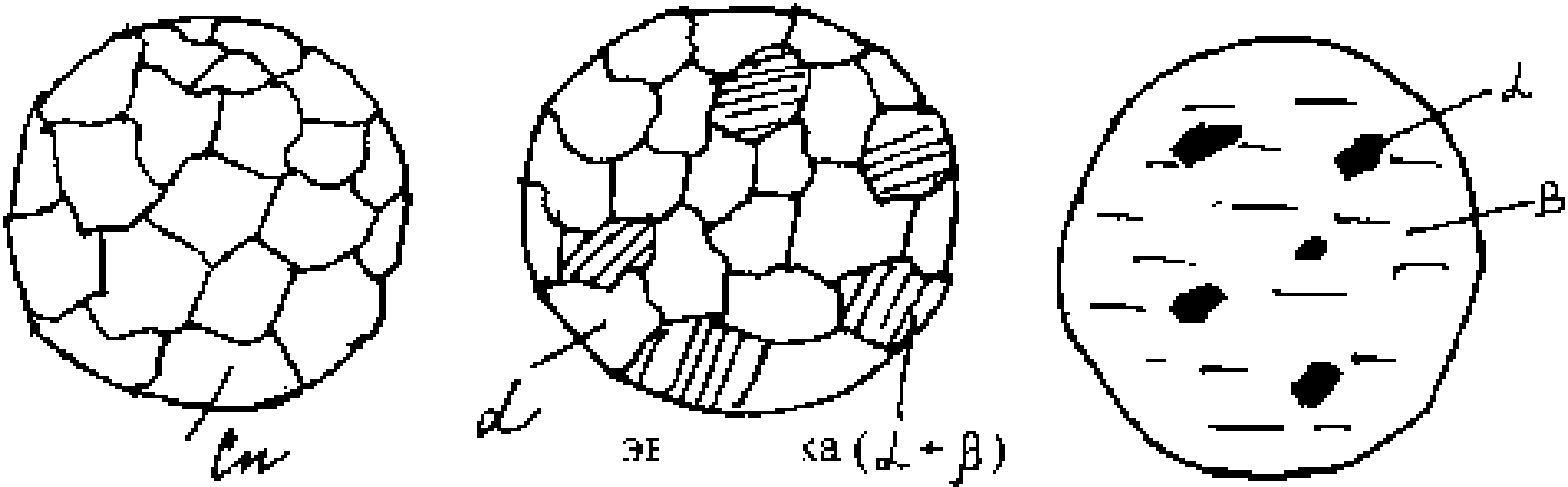
1ТСКТИ] Рис. 6
Задача № 4
Как изменится химический состав фаз в процессе кристаллизации сплава 1 (рис. 7)?

Задача № 5
Рис. 7
Постройте кривую охлаждения сплава 1 (рис. 7) и проверьте ее по правилу фаз Гиббса. Объясните полученные значения числа степеней свободы на разных этапах охлаждения.
25
