
Формиат натрия
2 НСООNa + H2 SO4 → 2 НСООН + Na SO4
А также способы получения уксусной кислоты:
а) каталитическое окисление альдегидов:
О
//
2 СН3 – С + О2 → 2 СН3 - СООН
\
Н
б) синтез из метанола и оксида углерода:
СН3ОН + СО → СН3СООН
Катализатор фтористый бор, фосфорная кислота, хлорид цинка, температура 200-300 0С, давление до 100 МПа.
При знакомстве с высшими предельными карбоновыми кислотами, вам необходимо запомнить формулы пальмитиновой С15Н31СООН и стеариновой С17Н35СООН кислот; нахождение их в природе в составе жиров и масел; получение этих кислот окислением парафина, а также гидролизом триацилглицеринов ( [1] стр.232.). Изучите применение высших предельных карбоновых кислот в пищевой промышленности.
Из непредельных карбоновых кислот широко применяются в пищевой промышленности в качестве консерванта сорбиновая кислота (СН3-СН=СН-СН=СН – СООН). Она безвредна и является активным антисептиком, особенно в кислой среде, она полностью подавляет развитие дрожжей и плесневых грибов. Применяют сорбиновую кислоту для консервирования фруктовых компотов, плодово-ягодных пюре и соков, соленых и квашеных овощей и маринадов.
Важно отметить, что в углеводородном радикале непредельных карбоновых кислот имеются кратные связи. С этим связана некоторая способность химических свойств: кислотность непредельных кислот выше, чем соответствующих предельных. ([2] § 99 стр.230).
Ряд свойств непредельных кислот обусловлен наличием кратных связей (реакции присоединения). Важно отметить, что свойства ά,β – непредельных кислот специфичны. Так, присоединение галогенводородов и гидратация идут для них против правила Марковникова:
О О
// //
СН2 = СН – С + НBr → CH2Br – CH2 – С
\ \
ОН ОН
Для непредельных кислот характерно присоединение брома (или йода). Обратите внимание, что по числу присоединившихся молекул брома (или йода) можно определить число кратных связей.
О O
// //
СН3 – СН = СН – СН = СН – С + 2 I 2 → СН3 – СН - СН – СН - СН – С
\ | | | | \
ОН I I I I ОН
Заметьте, что непредельные кислоты легко окисляемы (уравнения реакции подробно приведены ([2] § 99 стр.231)).
а) осторожное окисление
О O
 // [ОН-],
КMnO4
/ СН3
– СН = СН – СН = СН – С
СН3
– СН - СН – СН - СН – С
// [ОН-],
КMnO4
/ СН3
– СН = СН – СН = СН – С
СН3
– СН - СН – СН - СН – С
\ | | | \
ОН OH OH OH OH ОН
б) при энергичном окислении наблюдается разрыв молекулы по месту двойной связи, и образуются продукты, по которым можно установить положение двойной связи.
Из высших непредельных кислот надо знать олеиновую, линоленовую и линолевую кислоты. Олеиновая кислота (С17Н33СООН), а также пальмитиновая и стеариновая кислоты входят в состав сложных эфиров глицерина и поэтому являются основными компонентами жиров.
Линолевая С17Н31СООН и линоленовая С17Н29СООН кислоты в составе сложных эфиров глицерина (глицеридов) образуют главную часть льняного и конопляного масел.
Олеиновая кислота С17Н33СООН: СН3 – (СН2)7 - СН
||
СН3 – (СН2)7 - СН
это бесцветная жидкость, затвердевающая на холоде.
Линолевая кислота С17Н31СООН:
СН3—(СН2)4—СН = СН—СН2—СН = СН—(СН2)7 -- СООН
светло-жетая маслянистая жидкость, нерастворимая в воде.
Линоленовая кислота С17Н29СООН:
СН3—СН2—СН=СН—СН2 –СН=СН—СН2—СН=СН—(СН3)7—СООН
бесцветная жидкость, не растворимая в воде. Для вышеприведенных кислот, помимо общих свойств, характерны реакции по месту двойной связи: реакции присоединения, реакции полимеризации и окисления.
При изучении предельных двухосновных карбоновых кислот запомните формулу щавелевой кислоты, ее строение и применение в пищевой промышленности.
Обратите внимание на особенности ее взаимодействия со щелочами и спиртами, способность декарбоксилироваться при нагревании и на легкую окисляемость.
Запомните реакцию разложения щавелевой кислоты при нагревании в присутствии H2SO4(к):
Н2SO4 200 С
СО2+СО+Н2О ------ НООС—СООН -----СО2+НСООН
Изучая бензойную кислоту, как основного представителя ароматических кислот, обратите внимание на химические свойства:
а) обусловленные наличием карбоксильной группы:
С6Н5СООН + NаОН → С6Н5ОNа + Н2О
С6Н5СООН + К2О → С6Н5ОК + Н2О
2 С6Н5СООН + 2 Nа → 2 С6Н5ОNа + Н2
[H+]
С6Н5СООН + СН3ОН → С6Н5ООСН3 + Н2О
б) обусловленные наличием ароматического кольца:
галогенирование

+ Br2 + HBr
\
Br
м- бромбензойная кислота
+ HNO3 + H2O
\
NO2
м- нитробензойная кислота
+ H2SO4 + HBr
\
SO3H
м- сульфобензойная кислота
Обратите внимание, что карбоксильная группа является мета-ориентантом.
Изучите строение, номенклатуру и изомерию оксикислот.
Учтите, что оксикислоты – соединения со смешанными функциями, они содержат одновременно гидроксильные и карбоксильные группы, и поэтому обладают свойствами карбоновых кислот, и свойствами спиртов. Для оксикислот различают понятия основности и атомности. Основность характеризуется числом карбоксильных групп в молекуле, а атомность - числом гидроксильных групп.
Например: О
//
СН3 – СН4 – СН2– С
| \
ОН ОН
β-гидроксибутановая кислота является двухатомной одноосновной кислотой.
Важным свойством оксикислот является их оптическая активность и стереоизомерия, из-за наличия в молекулах этих соединений асимметрического атома углерода (имеющего четыре разных заместителя). Этот вопрос разберите самостоятельно по учебнику ([2] § 144 стр.316).
Обратите внимания на химические реакции, характеризующие химические свойства оксикислот как спиртов:
а) образование простых эфиров:
СН3 – СН – СООН + (СН3)2SО4 → СН3 – СН – СООН + (СН3)7НSО4
| |
ОН О – СН3
б) сложных эфиров О
\\ [ H+]

 СН3
– СН – СООН + С – СН3
СН3
– СН – СООСН3
+ Н2О
СН3
– СН – СООН + С – СН3
СН3
– СН – СООСН3
+ Н2О
| / |
ОН Cl О – С - СН3 ||
О
и как кислоты:
а) образование сложных эфиров:
[ H+]
СН3 – СН – СООН + СН3ОН → СН3 – СН – СООСН3 + Н2О
| |
ОН ОН
б) образование солей:
1) СН3 – СН – СООН + NаОН → СН3 – СН – СООNа + Н2О
| |
ОН ОН
2)СН3 – СН – СООН + Na2CO3 → СН3 – СН – СООNa + Н2О + CO2
| |
ОН ОН
3) СН3 – СН – СООН + Nа → СН3 – СН – СООNа + Н2
| |
ОН ОН
Изучите отдельных представителей оксикислот: молочную , яблочную, винную и лимонную.
Вам необходимо знать их строение, применение в пищевой промышленности, а также отношение к нагреванию.
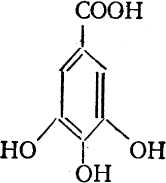
По учебнику ознакомьтесь с дубильными веществами и запомните, что многие из них представляют собой сложные эфиры, построенные из нескольких молекул галловой кислоты:
Классификация карбоновых кислот?
Напишите структурные формулы следующих кислот: масляной, олеиновой, пальмитиновой, щавелевой, молочной, сорбиновой, стеариновой, бензойной. Охарактеризуйте их значение в пищевой промышленности.
Чем обусловлено явление оптической изомерии? Что такое рацемат?
Напишите структурные формулы кислот состава С7Н14О2, содержащих в главной цепи пять и шесть атомов углерода. Назовите их по современной номенклатуре.
Осуществите превращения:
а) СН4 → С2Н6 → С2Н4 → СН3СОН → С2Н5ОН → СН3СООН
б) СаС2→ С2Н6 → СН3СОН → СН3СООН → СН3СООС2Н5
Напишите формулы кислого и среднего эфира этанола и щавелевой кислоты.
Сколько килограмм этановой кислоты можно получить при окислении 9,9 кг этаналя, если выход продукта реакции равен 85%?
