
- •Введение
- •Глава 1. Предмет, задачи и объекты промышленной экологии
- •1.1. Основные понятия и принципы экологии
- •1.2. Промышленная экология и другие области научного знания
- •1.3. Природные ресурсы и их классификация
- •1.4. Источники загрязнения и загрязняющие окружающую среду вещества
- •1.5. Глобальные экологические проблемы
- •1.6. Концепция устойчивого развития
- •1.7. Воздействие основных видов экономической деятельности на окружающую среду
- •Объемы выбросов загрязняющих веществ в атмосферный воздух от стационарных источников по видам экономической деятельности
- •1.8. Характеристика выбросов, сбросов вредных веществ и отходов по видам экономической деятельности
- •Показатели, характеризующие воздействие на окружающую среду отдельных видов деятельности по разделу «Производство и распределение электроэнергии, газа и воды» в 2008 году
- •Показатели, характеризующие воздействие на окружающую среду отдельных видов деятельности по разделу «Сельское хозяйство, охота и лесное хозяйство» в 2008 году
- •Выбросы загрязняющих веществ в атмосферу автотранспортными средствами в 2008 году, тыс. Т
- •Библиографический список
- •Глава 2. Загрязнение атмосферы. Методы очистки газовых выбросов предприятий и транспорта
- •2.1. Источники загрязнения атмосферы и распространения загрязняющих веществ
- •Характерные выбросы в атмосферу основных производств химичской промышленности
- •2.2. Строение и состав атмосферы
- •2.3. Характеристика основных источников загрязнения атмосферы и загрязняющих веществ
- •2.4. Трансформация загрязняющих веществ в атмосфере – химические и фотохимические процессы
- •2.5. Рассеивание загрязняющих веществ в атмосфере
- •2.6. Влияние метеорологических параметров и рельефа местности на рассеивание загрязняющих веществ
- •Повторяемость (в днях) направлений и скоростей ветра в Москве (январь)
- •2.7. Расчет приземных концентраций загрязняющих веществ с использованием математических моделей
- •2.8. Нормирование качества воздуха в Российской Федерации
- •2.9. Предельно допустимые выбросы загрязняющих веществ в атмосферу
- •2.10. Методы очистки газовых выбросов предприятий и транспорта
- •2.11. Мероприятия по защите воздушного бассейна на промышленных предприятиях
- •2.11.1. Пылеулавливание
- •2.11.2. Газоочистка
- •2.11.3. Новые конструкции воздушных фильтров-пылегазоуловителей
- •2.12. Очистка газовых выбросов энергетических установок и двигателей внутреннего сгорания
- •2.12.1. Основные экологические мероприятия в области энергетики
- •2.12.2. Мероприятия по снижению загрязнения атмосферного воздуха автотранспортом
- •Система мероприятий по снижению загрязнения атмосферного воздуха автотранспортом
- •Библиографический список
- •Глава 3. Загрязнение природных вод. Методы очистки сточных вод
- •3.1. Основные свойства воды и экологические проблемы гидросферы
- •3.2. Особенности загрязнения водных объектов углеводородами нефти
- •3.3. Нормирование качества воды
- •3.4. Характеристика сточных вод химических предприятий
- •3.5. Снижение и предотвращение воздействия сточных вод химических предприятий на водную среду
- •3.6. Методы очистки и обезвреживания производственных сточных вод
- •3.6.1. Механические методы очистки
- •3.6.2. Физико-химические методы очистки
- •3.6.3. Химические методы очистки
- •3.6.4. Электрохимические методы очистки
- •3.6.5. Биологические методы очистки
- •Библиографический список
- •Глава 4. Охрана недр и земель. Обращение с отходами
- •4.1. Химическая промышленность как источник образования отходов
- •4.2. Нормирование вредных веществ в почве
- •4.3. Принципы обращения с отходами. Утилизация отходов
- •4.4. Методы переработки твердых отходов
- •4.5. Способы размещения твердых и жидких отходов на поверхности и в подземных горизонтах земли
- •4.5.1. Полигоны по обезвреживанию и захоронению токсичных промышленных отходов
- •4.5.2. Способы размещения твердых и жидких отходов в подземных горизонтах земли
- •4.5.3. Использование промышленных отходов в качестве заполнителя при рекультивации карьеров
- •4.5.4. Размещение радиоактивных отходов
- •4.5.5. Требования безопасности при организации хранилищ
- •4.6. Рекультивация промышленно используемых земель
- •4.7. Методы и средства снижения техногенного воздействия на ландшафт и почву
- •Библиографический список
- •Глава 5. Ресурсо- и энергоэффективность. Принципы создания малоотходных производств
- •5.1. Энерго- и ресурсоэффективность
- •5.1.1. Нормативы допустимых физических воздействий на окружающую среду
- •5.1.2. Взаимосвязь энерго- и ресурсоэффективности
- •5.1.3. Принципиальные пути рационального использования ресурсов
- •5.1.4. Наилучшие доступные технологии
- •5.2. Принципы создания малоотходных производств
- •5.3. Экологический риск
- •5.3.1. Источники экологического риска и подходы к его оценке
- •5.3.2. Схема экологической оценки риска
- •5.3.3. Влияние неопределенности на процессы экологической оценки риска
- •5.3.4. Модели для расчета экологического риска
- •Библиографический список
- •Глава 6. Экологическое регулирование
- •6.1. Оценка воздействия хозяйственной и иной деятельности на окружающую среду
- •6.2. Экологический мониторинг
- •6.3. Экологический контроль
- •6.4. Экологический аудит
- •Библиографический список
- •Глава 7. Экономика природопользования
- •7.1. Виды экономического ущерба, причиняемого народному хозяйству загрязнением окружающей природной среды
- •7.2. Базовые нормативы платы за выбросы, сбросы загрязняющих веществ, размещение отходов
- •7.3. Определение массы загрязняющих веществ, поступающих в окружающую среду. Корректировка размеров платежей природопользователей
- •7.4. Экологическое страхование
- •Библиографический список
- •Заключение
- •Содержание
- •Глава 1. Предмет, задачи и объекты промышленной экологии 5
- •Глава 2. Загрязнение атмосферы. Методы очистки газовых выбросов предприятий и транспорта 62
- •Глава 3. Загрязнение природных вод. Методы очистки сточных вод 135
- •Глава 4. Охрана недр и земель. Обращение с отходами 200
- •Глава 5. Ресурсо- и энергоэффективность. Принципы создания малоотходных производств 227
- •Глава 6. Экологическое регулирование 261
- •Глава 7. Экономика природопользования 290
- •125047 Москва, Миусская пл., 9
3.6.3. Химические методы очистки
К химическим методам очистки сточных вод относят нейтрализацию, окисление и восстановление. Все эти методы связаны с расходом различных реагентов, поэтому дороги. Их применяют для удаления растворимых веществ и в замкнутых системах водоснабжения. Химическую очистку проводят иногда как предварительную перед биологической очисткой или после нее как метод доочистки сточных вод. Сточные воды, содержащие минеральные кислоты или щелочи, перед сбросом их в водоемы или перед использованием в технологических процессах нейтрализуют. Практически нейтральными считаются воды, имеющие рН 6,5 – 8,5.
Нейтрализацию можно проводить различным путем: смешиванием кислых и щелочных сточных вод, до6авлением реагентов, фильтрованием кислых вод через нейтрализующие материалы, абсорбцией кислых газов щелочными водами или абсорбцией аммиака кислыми водами. Выбор метода нейтрализации зависит от объема и концентрации сточных вод, от режима их поступления, наличия и стоимости реагентов. В процессе нейтрализации могут образовываться осадки, количество которых зависит от концентрации и состава сточных вод, а также от вида и расхода используемых реагентов.
Нейтрализация смешиванием. Этот метод применяют, если на одном предприятии или на соседних предприятиях имеются кислые и щелочные воды, не загрязненные другими компонентами. Кислые и щелочные воды смешивают в емкости (рис. 3.8) с мешалкой и без мешалки. В последнем случае перемешивание ведут воздухом при его скорости в линии подачи 20 – 40 м/с.
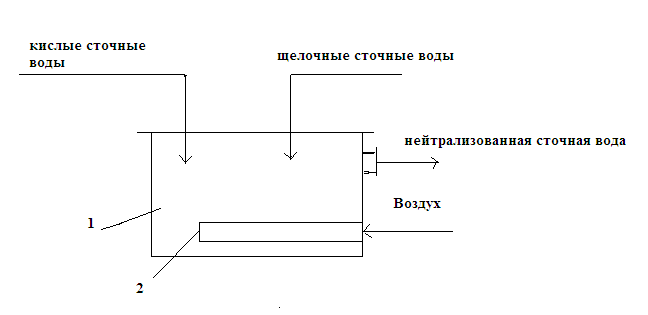
Рис. 3.8. Схема нейтрализатора смешения: 1 – емкость; 2 – распределитель воздуха
При переменной концентрации сточных вод в схеме предусматривают установку усреднителя или обеспечивают автоматическое регулирование подачи в камеру смешивания. Расчет соотношения сточных вод, направляемых в камеру смешения, проводят по стехиометрическим уравнениям.
При избытке кислых и щелочных вод добавляют соответствующие реагенты. Принципиальная схема водно-реагентной нейтрализации приведена на рис. 3.9. Нейтрализованную воду используют в производстве, а осадок обезвреживают на шламовых площадках или вакуум-фильтрах.
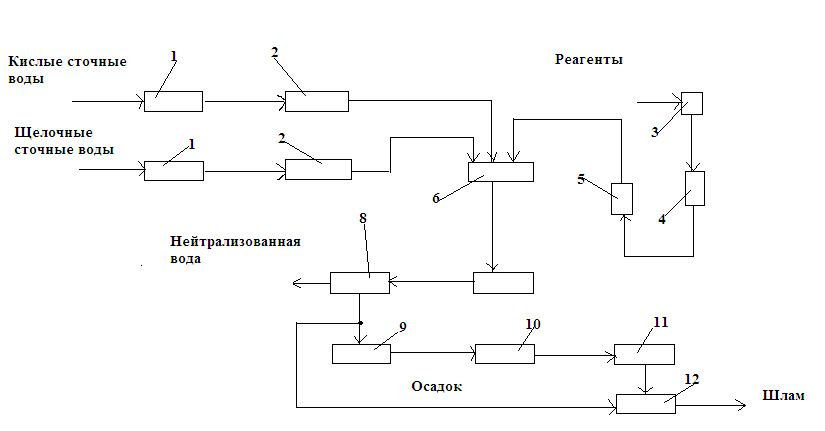
Рис. 3.9. Схема станции реагентной нейтрализации: 1 – песколовки; 2 – усреднители; 3 – склад реагентов; 4 – растворный бак; 5 – дозатор; 6 – смеситель; 7 – нейтрализатор; 8 – отстойник; 9 – осадкоуплотнитель; 10 – вакуум-фильтр; 11 – накопитель обезвоженных осадков; 12 – шламовая площадка
Нейтрализация добавлением реагентов. Для нейтрализации кислых вод могут быть использованы: NaOH, КОН, Na2COз, NH4OH (аммиачная вода), CaCO3, MgCO3 доломит (СаСО3, MgCO3), цемент. Однако наиболее дешевым реагентом является гидроксид кальция (известковое молоко) с содержанием активной извести Са(ОН)2 5 – 10 %. Соду и гидроксид натрия следует использовать, если они являются отходами производства. Иногда для нейтрализации применяют различные отходы производства. Например, шлаки сталеплавильного, феррохромового и доменного производств используют для нейтрализации вод, содержащих серную кислоту.
Реагенты выбирают в зависимости от состава и концентрации кислой сточной воды. При этом учитывают, будет ли в процессе образовываться осадок или нет. Различают три вида кислотосодержащих сточных вод: 1) воды, содержащие слабые кислоты (Н2СО3, СН3СООН); 2) воды, содержащие сильные кислоты (НСI, HN03). Для их нейтрализации может быть использован любой названный выше реагент. Соли этих кислот хорошо растворимы в воде; 3) воды, содержащие серную и сернистую кислоты. Кальциевые соли этих кислот плохо растворимы в воде и выпадают в осадок.
Известь для нейтрализации вводят в сточную воду в виде гидроксида кальция (известкового молока; «мокрое дозирование») или в виде сухого порошка («сухое» дозирование). Схема установки для нейтрализации кислых вод известковым молоком показана на рис. 3.10.
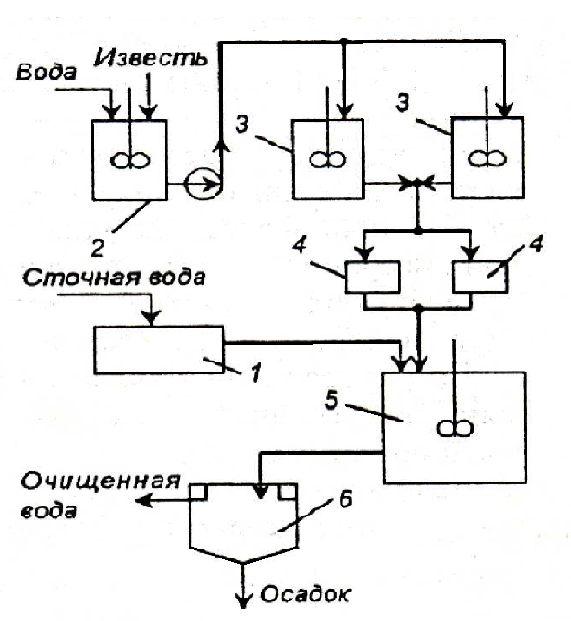
Рис. 3.10. Схема установки нейтрализации кислотных сточных вод гидроксидом кальция (известковым молоком): 1 – усреднитель; 2 – аппарат для гашения извести (CaO); 3 – растворные баки; 4 – дозаторы; 5 – нейтрализаторы; 6 – отстойник
Для гашения извести используют шаровые мельницы мокрого помола, в которых одновременно происходят тонкое измельчение и гашение. Для смешения сточных вод с известковым молоком применяют гидравлические смесители различных типов: дырчатые, перегородчатые, вихревые, с механическими мешалками или барботажные с расходом воздуха 5 – 10 м3/ч на 1 м2 свободной поверхности.
При нейтрализации сточных вод, содержащих серную кислоту, известковым молоком в осадок выпадает гипс CaSO4·H2O. Растворимость гипса мало меняется с температурой. При перемещении таких растворов происходит отложение гипса на стенках трубопроводов и их забивка. Для устранения забивки трубопроводов необходимо промывать их чистой, водой или добавлять в сточные воды специальные умягчители, например гексаметафосфат. Увеличение скорости движения нейтрализованных вод способствует уменьшению отложений гипса на стенках трубопроводов.
Для нейтрализации щелочных сточных вод используют различные кислоты или кислые газы.
Нейтрализация фильтрованием кислых вод через нейтрализующие материалы. В этом случае для нейтрализации кислых вод проводят фильтрование их через слой магнезита, доломита, известняка, твердых отходов (шлак, зола). Процесс ведут в фильтрах-нейтрализаторах, которые могут быть горизонтальными или вертикальными. Для вертикальных фильтров используют куски известняка или доломита размером 30 – 80 мм. При высоте материала 0,85 – 1,2 м скорость должна быть не более 5 м/с, а продолжительность контакта не менее 10 мин. У горизонтальных фильтров скорость течения сточных вод 1 – 3 м/с.
Нейтрализация кислыми газами. Для нейтрализации щелочных сточных вод в последнее время начинают использовать отходящие газы, содержащие CO2, SO2, NO2, N2O3. Применение кислых газов позволяет не только нейтрализовать сточные воды, но и одновременно производить высокоэффективную очистку самих газов от вредных компонентов.
Использование для нейтрализации щелочных сточных вод диоксида углерода имеет ряд преимуществ по сравнению с применением серной или соляной кислот, позволяет резко снизить стоимость процесса нейтрализации. Вследствие плохой растворимости CO2 уменьшается опасность переокисления нейтрализационных растворов.
Образующиеся карбонаты находят большее применение по сравнению с сульфатами или хлоридами, кроме того, коррозийные и токсичные воздействия ионов CO32- в воде меньше, чем ионов SO42- и Cl-.
Процесс нейтрализации может быть проведен в реакторах с мешалкой (рис. 3.11), в распылительных, пленочных и тарельчатых колоннах.
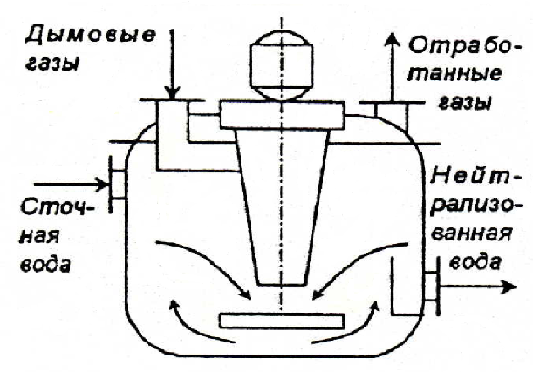
Рис. 3.11. Нейтрализатор щелочных сточных вод дымовыми газами
Дымовые газы вентилятором подают в кольцевое пространство вокруг вала мешалки и распределяют мешалкой в виде пузырьков и струй в сточной воде, поступающей внутрь реактора. Благодаря большой поверхности контакта между водой и газами происходит быстрая нейтрализация сточной воды. Присутствие в газах SO2 способствует нейтрализации щелочных сточных вод.
При проведении процесса в тарельчатых колоннах степень нейтрализации увеличивается с ростом скорости газа и уменьшением плотности орошения.
Количество кислого газа, необходимого для нейтрализации, может быть определено по уравнению массоотдачи:
M = χ·βж·F·Δc,
где М – количество кислого газа, необходимого для нейтрализации; χ – фактор ускорения; βж – коэффициент массоотдачи в жидкой фазе; F – поверхность контакта фаз; Δc – движущая сила процесса.
Фактор ускорения рассчитывают по формулам, приведенным ранее, а коэффициент – по формулам, имеющимся в литературе для различных конструкций массообменных аппаратов.
Нейтрализация щелочных вод дымовыми газами использована в ряде производств, в том числе и в асбестоцементном производстве. Сточные воды этих производств имеют рН=12 – 13 (≈80 мг-экв/дм3). Щелочность воды обусловлена постоянным выщелачиванием в нее гидроксида кальция. Нейтрализацию проводили диоксидом углерода дымовых газов (5 – 6 % СO2) в тарельчатом абсорбере.
Особенностью нейтрализации дымовыми газами сточных вод асбестоцементного предприятия является образование карбоната кальция, который может находиться в состоянии пересыщения и отлагается на внутренней поверхности оборудования. Для предотвращения образования в абсорбере карбонатных отложений процесс нейтрализации следует проводить по циркуляционной схеме (рис. 3.12). Сточная вода из усреднителя должна поступать в смеситель, где предварительно нейтрализуется частью воды, выходящей из абсорбера.
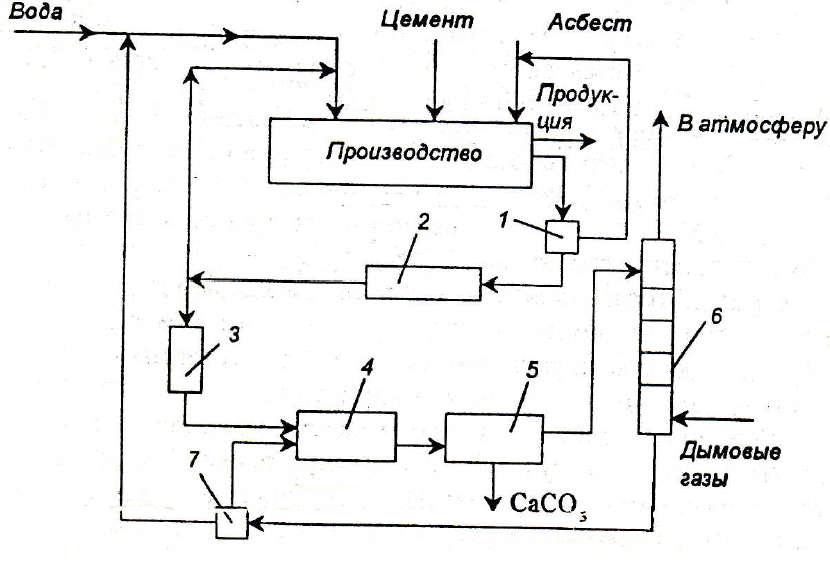
Рис. 3.12. Бессточная схема водопотребления асбестоцементного завода:
1 – фильтр; 2,5 – отстойники; 3 – усреднитель; 4 – смеситель; 6 – колонна; 7 – делитель потока воды
В смесителе протекают следующие реакции:
OH- + HCO3- → H2O + CO32- Ca2+ + CO32- → CaCO3
Образующийся осадок карбоната кальция осаждается в циркуляционной емкости.
Предварительную нейтрализацию сточной воды проводят с целью получения на входе в абсорбер смеси с таким водородным показателем, при котором смесь при окончательной нейтрализации в абсорбере дымовыми газами не образует карбонатных отложений. При этом в абсорбере протекают следующие реакции:
2OH- + CO2 → H2O + CO32- CO32- + CO2 + H2O → 2HCO3-
Отношение объемных расходов циркулирующей и сточной воды, при котором образуется смесь, не выделяющая карбонатных отложений, зависит от состава сточной воды и составляет от 2,5 до 4.
Для нейтрализации применяют абсорберы с крупнодырчатыми провальными тарелками с большим свободным сечением, например, тарелки со свободным сечением более 30 % и отверстиями размером 20x50 мм.
Нейтрализация щелочных вод дымовыми газами является примером ресурсосберегающей технологии, позволяющей исключить использование кислот, создать бессточную схему водопотребления. При этом ликвидируется сброс сточных вод, сокращается потребление свежей воды, а также очищаются дымовые газы от кислых компонентов (СО2, SO2 и др.) и пыли.
Окисление и восстановление. Для очистки сточных вод используют следующие окислители: газообразный и сжиженный хлор, диоксид хлора, хлорат кальция, гипохлориты кальция и натрия, перманганат калия, бихромат калия, пероксид водорода, кислород воздуха, пероксосерные кислоты, озон, пиролюзит и др.
В процессе окисления токсичные загрязнения, содержащиеся в сточных водах, в результате химических реакций переходят в менее токсичные, которые удаляют из воды. Очистка окислителями связана с большим расходом реагентов, поэтому их применяют только в тех случаях, когда вещества, загрязняющие сточные воды, нецелесообразно или нельзя извлечь другими способами, например, очистка от цианидов, растворенных соединений мышьяка и др. Активность вещества как окислителя определяется величиной окислительного потенциала. Из всех известных в природе окислителей первое место занимает фтор, который, однако, из-за высокой агрессивности не может быть использован на практике. Для других веществ величина окислительного потенциала равна: для озона – 2,07: для хлора – 0,94; для пероксида водорода – 0,68; для перманганата калия – 0,59.
Окисление хлором. Хлор и вещества, содержащие «активный» хлор, являются наиболее распространенными окислителями. Их используют для очистки сточных вод от сероводорода, гидросульфида, метилсернистых соединений, фенолов, цианидов и др. При введении хлора в воду образуются хлорноватистая (оксохлорат (I) водорода) и соляная (хлороводородная) кислоты:
Cl2 + H2O = HOCl + HCl
Далее происходит диссоциация хлорноватистой кислоты, степень которой зависит от pH среды. При pH=4 молекулярный хлор практически отсутствует:
HOCl ↔ H+ + OCl-
Сумма Cl2+ HOCl + OCl- называется свободным «активным» хлором.
В присутствии аммонийных соединений в воде образуется хлорноватистая кислота, хлорамин NH2Cl и дихлорамин NHCl2. Хлор в виде хлорамина называют «активным» хлором.
Процесс хлорирования проводят в хлораторах периодического и непрерывного действия, напорных и вакуумных. Принципиальная схема очистки вод хлорированием показана на рис. 3.13. Хлорирование проводится в емкости, включенной в систему циркуляции. В инжекторе газообразный хлор захватывается сточной водой, циркулирующей в системе до тех пор, пока не будет достигнута заданная степень окисления, после чего вода выводится для использования.
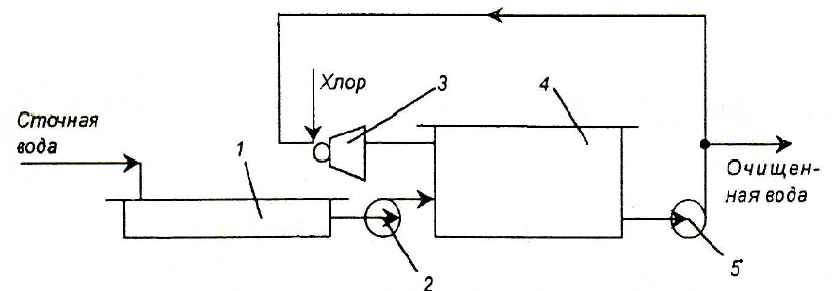
Рис. 3.13. Схема установки для очистки воды хлорированием:
1 – усреднитель; 2,5 – насосы; 3 – инжектор; 4 – емкость
При обезвреживании вод от цианидов процесс проводят в щелочной среде (pH=9). Цианиды можно окислить до элементного азота и оксида углерода по уравнениям:
CN- + 2OH- + Cl2 → CNO- + 2Cl- + H2O
2CNO- + 4OH- + 3Cl2 → 2CO2 + 6Cl- + N2 + 2H2O
Источниками «активного» хлора могут быль также хлорат кальция, гипохлориты, хлораты, диоксид хлора.
Хлорат кальция (хлорную известь) получают при взаимодействии:
Ca(OH)2 + Cl2 = CaOCl2 + H2O
Гипохлорит (оксохлорат) натрия образуется при пропускании газообразного хлора через раствор щелочи:
Cl2 + 2NaOH = NaClO + NaCl + Н2O
Гипохлорит кальция приготовляют хлорированием гидроксида кальция при 25 – 30ºC:
2Ca(OH)2 + 2Cl2 = Ca(ClO)2 + CaCl2 + 2H2O
Промышленность выпускает двухосновную соль Ca(ClO2)·2Ca(OH)2·2H2O.
Сильным окислителем является хлорат натрия NaClO2, который разлагается с выделением ClO2. Диоксид хлора – зеленовато-желтый ядовитый газ, обладающий более интенсивным запахом, чем хлор. Для его получения проводят следующие реакции:
2NaClO2 + Cl2 → 2ClO2 + 2NaCl
5NaClO2 + 4HCl → 5NaCl + 4ClO2 + 2H2O
При окислении цианидов «активным» хлором процесс можно проводить в одну ступень до получения цианатов:
CN- + OCl- →CNO- + Cl-
Окисление цианидов до цианитов происходит за счет атомного кислорода в момент его выделения из окислителя. Образовавшиеся цианаты легко гидролизуются до карбонатов:
CNO- + 2H2O → CO32- + NH4+
Скорость гидролиза зависит от pH среды. При pH=5,3 за сутки гидролизуется около 80 % цианатов. В двухступенчатом процессе цианиды окисляются до N2 и CO2. На первой ступени вводят дополнительное количество окислителя, и реакция протекает по уравнению:
2CNO- + 3OCl- + H2O → 2CO2 + N2 + 2OH- + 3Cl-
Во время реакций pH поддерживают в пределах 8 – 11. Контроль полноты окисления производят по остаточному «активному» хлору, концентрация которого должна быть не менее 5 – 10 мг/дм3.
Товарный хлорат кальция содержит до 33 % «активного» хлора, а гидрохлорид кальция – до 60 %. Потребность реагентов x1 (в кг/сут) для окисления подсчитывается по формуле:
x1 = xCl·Qn / a
где xCl – расход «активного» хлора, необходимого для окисления цианидов, кг/м3; Q – расход воды, м3/сут.; n – коэффициент избытка реагента (т=1,2-1,3); a – содержание «активного» хлора в реагенте, в долях единицы.
Окисление пероксидом водорода. Пероксид водорода является бесцветной жидкостью, в любых соотношениях смешивается с водой. Она может быть использована для окисления нитритов, альдегидов, фенолов, цианидов, серосодержащих отходов, активных красителей. Промышленность выпускает 85 – 95%-й пероксид водорода и пергидроль, содержащий 30 % H2O2. Пероксид водорода токсичен. ПДК в воде составляет 0,1 мг/дм3.
Пероксид водорода в кислой и щелочной средах разлагается по следующим схемам:
2H+ + H2O2 + 2e → 2 H2O 2OH- + H2O2 + 2e → 2 H2O + 2O2-
В кислой среде более отчетливо выражена окислительная функция, а в щелочной восстановительная.
В кислой среде пероксид водорода переводит соли двухвалентного железа в соли трехвалентного, азотистую кислоту – в азотную, сульфиды – в сульфаты. Цианиды в цианаты окисляются в щелочной среде (pH=9–12).
В разбавленных растворах процесс окисления органических веществ протекает медленно, поэтому используют катализаторы – ионы металлов переменной валентности (Fe2+, Cu2+, Mn2+, Co2+, Cr2+, Ag+). Например, процесс окисления пероксидом водорода с солью железа протекает весьма эффективно при pH=3 – 4,5. Продуктами окисления являются муконовая и малеиновая кислоты.
В процессах водообработки используют не только окислительные, но и восстановительные свойства пероксида водорода. В нейтральной и слабощелочной средах он легко взаимодействует с хлором и гипохлоритами, переводя их в хлориды:
H2O2 + Cl2 → O2 + 2HCl NaClO + H2O2 → NaCl + O2 + H2O
Эти реакции используют при дехлорировании воды.
Избыток пероксида водорода можно удалять, обрабатывая его диоксидом марганца:
MnO2 + H2O2 + 2HCl → MnCl2 + 2H2O + O2
Перспективным является окисление загрязнений пероксосерными кислотами: пероксомоносерной H2SO5 и пероксодисерной H2S2O8. Например, фенол окисляется пероксомоносерной кислотой (кислота Каро) при pH=10. Этим методом возможно снизить содержание фенола до 5 – 10 %. Скорость окисления зависит от соотношения H2SO5/C6H5OH и повышается с ростом температуры.
Разрушение цианидов под действием пероксосерных кислот протекает также очень быстро. При этом в случае небольших концентраций цианидов (0,01 – 0,05 %) в сточной воде используют H2SO5, а при высоких концентрациях – H2S2O8. Оптимальным условиям соответствует pH=9. В нейтральной среде реакция окисления резко замедляется под действием ионов железа, которые образуют ферроцианы, не подвернающиеся окислению.
Окисление кислородом воздуха. Кислород воздуха используют при очистке воды от железа для окисления соединений двухвалентного железа в трехвалентное с последующим отделением от воды гидроксида железа. Реакция окисления в водном растворе протекает по схеме:
4Fe2+ + O2 + 2H2O = 4Fe3+ + 4OH- Fe3+ + 3H2O = Fe(OH)3 + 3H+
Окисление проводят при аэрировании воздуха через сточную воду в башнях с хордовой насадкой. Образующийся гидроксид железа отстаивают в контактном резервуаре, а затем отфильтровывают. Использование колонн с кусковой насадкой или кольцами Рашига нецелесообразно, так как происходит зарастание насадки. Возможен процесс упрощенной аэрации. В этом случае над поверхностью фильтра разбрызгивают воду, которая в виде капель падает на поверхность фильтрующей загрузки. При контакте капель воды с воздухом происходит окисление железа.
Кислородом воздуха окисляют также сульфидные стоки целлюлозных, нефтеперерабатывающих и нефтехимических заводов. Процесс окисления гидросульфидной и сульфидной серы протекает через ряд стадий при изменении валентности серы с -2 до +6:
S2- → S → SnO62- → S2O32- → SO32- → SO42-
При этом при окислении гидросульфида и сульфида до тиосульфата pH раствора понижается, а при окислении сульфида до сульфита и сульфата активная реакция среды не изменяется.
С повышением температуры и давления скорость реакции и глубина окисления сульфидов и гидросульфидов увеличивается. Теоретически на окисление 1 г сульфидной серы расходуется 1 г кислорода. Принципиальная схема установки окисления сульфидов приведена на рис. 3.14.
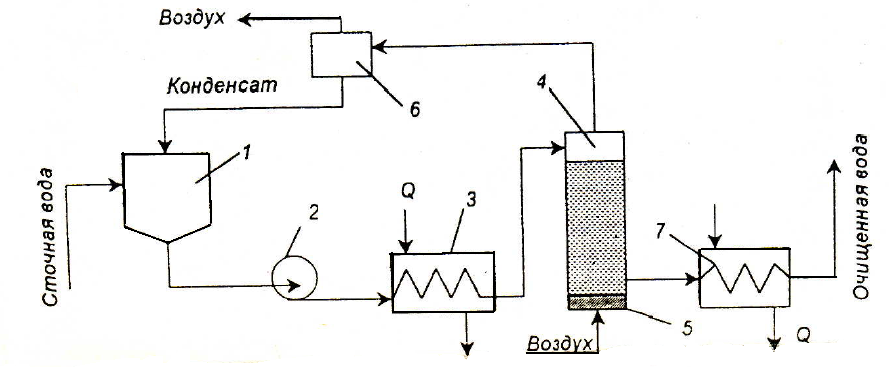
Рис. 3.14. Схема установки окисления сульфидов: 1 – приемный резервуар; 2 – насос; 3 – теплообменник; 4 – окислительная колонна; 5 – воздухораспределительное устройство; 6 – сепаратор; 7 – холодильник
Окисление пиролюзитом. Процесс проводят фильтрацией сточной воды через этот материал или в аппаратах с мешалкой. Пиролюзит является природным материалом, состоящим в основном из диоксида марганца. Его широко используют для окисления трехвалентного мышьяка в пятивалентный:
H3AsO3 + MnO2 + H2SO4 = H3AsO4 + MnSO4 + H2O
Повышение температуры способствует увеличению степени окисления. Оптимальный режим окисления следующий: расход МпО2 – четырехкратный по сравнению со стехиометрическим, кислотность воды 30 – 40 г/л, температура воды 70 – 80 °С.
Озонирование. Окисление озоном позволяет одновременно обесцветить воду, устранить привкусы и запахи и обеззаразить. Озонированием можно очищать сточные воды от фенолов, углеводородов нефти, сероводорода, соединений мышьяка, ПАВ, цианидов, красителей, канцерогенных ароматических углеводородов, пестицидов и др.
Озон – газ бледно-фиолетового цвета. В природе находится в верхних слоях атмосферы. При -111,9 °С озон превращается в нестойкую жидкость темно-синего цвета. Физико-химические свойства озона: относительная молекулярная масса 48; плотность (при 0 °С и давлении 0,1 МПа) 2,154 г/дм3; температура плавления 192,5 °С: теплота образования 143,64 кДж/моль; коэффициент растворимости в воде при 0 °С – 0,49, при 20 °С – 0,29; окислительно-восстановительный потенциал 2,07 В.
Чистый озон взрывоопасен, так как при его разложении высвобождается значительное количество тепла; очень токсичен. Максимальная допустимая концентрация в воздухе рабочей зоны равна 0,0001 мг/м3. Обеззараживающее действие озона основано на высокой окислительной способности, обусловленной легкостью отдачи им активного атома кислорода (О3 = О2 + О). Озон окисляет все металлы, кроме золота, превращая их в оксиды.
В водном растворе озон диссоциирует быстрее, чем в воздухе. Очень быстро диссоциирует в слабощелочных растворах. В кислотных растворах озон проявляет большую стойкость. В чистом сухом воздухе он разлагается очень медленно.
При обработке воды озоном происходит разложение органических веществ и обеззараживание воды: бактерии погибают в несколько тысяч раз быстрее, чем при обработке воды хлором Растворимость озона в воде зависит от рН и содержания в воде растворимых веществ. Небольшое содержание кислот и нейтральных солей увеличивает растворимость озона. Присутствие щелочей снижает растворимость О3.
Действие озона в процессе окисления может происходить в трех различных направлениях: непосредственное окисление с участием одного атома кислорода; присоединение целой молекулы озона к окисляемому веществу с образованием озонидов; каталитическое усиление окисляющего воздействия кислорода, присутствующего в озонированном воздухе.
Механизм реакции разложения озона довольно сложен, поскольку на скорость деструкции влияет множество факторов: условия перехода озона из газовой фазы в жидкость, соотношение между парциальным давлением газа и его растворимостью в водном растворе, кинетика окисления озоном находящихся в воде загрязнений.
При диспергировании озона в воду идут два основных процесса – окисление и дезинфекция. Кроме того, происходит значительное обогащение воды растворенным кислородом. Окисление веществ может быть прямое и непрямое, а также может осуществляться катализом и озонолизом.
Примером прямых реакций может служить окисление ряда органических и минеральных веществ (Fe2+, Мп2+), которые после озонирования осаждаются в форме нерастворимых гидроксидов или переводятся в диоксиды и перманганаты.
Кинетика прямых реакций окисления может быть выражена уравнением:
ln [ct]/[c0] = k[O3]t
где [ct], [c0] – соответственно конечная и начальная концентрации веществ, мг/дм3; k – константа скорости реакции, л/(моль·с); [O3] – средняя концентрация озона во время прохождения реакции, мг/дм3; t – продолжительность озонирования, с.
Непрямое окисление – окисление радикалами, например, группой ОН и другими, образующимися в результате перехода озона из газовой фазы в жидкость и его саморазложения. Интенсивность непрямого окисления прямо пропорциональна количеству разложившегося озона и обратно пропорциональна концентрации присутствующих в воде загрязнителей.
Озонолиз представляет собой процесс фиксации озона на двойной или тройной углеродной связи с последующим ее разрывом и образованием озонидов, которые, как и озон, являются нестойкими соединениями и быстро разлагаются.
